题目内容
下列说法中错误的是( )
| A、当中心原子的配位数为6时,配合单元常呈八面体空间结构 |
| B、SO3为平面正三角形结构 |
| C、已知[Cu(NH3)2]2+的中心原子采用sp杂化,则它们的空间构型为直线型 |
| D、配位数为4的配合物均为正四面体结构 |
考点:配合物的成键情况,原子轨道杂化方式及杂化类型判断
专题:化学键与晶体结构
分析:A、当中心原子的配位数为6时,根据价层电子对互斥理论,形成的配合单元常呈八面体空间结构,这样的分布配位键间的作用力最小,物质最稳定,据此判断;
B、SO3中中心原子硫原子的价层电子对数为
=3,中心原子没有孤电子对,所以分子的空间构型为平面正三角形,据此判断;
C、[Cu(NH3)2]2+的中心原子采用sp杂化,形成两个杂化轨道,与两个氨分子形成两个配位键,中心原子无孤电子对,所以分子的空间构型为直线型,据此判断;
D、配位数为4的配合物可以为正四面体结构,也可以为平面四边形结构,据此判断;
B、SO3中中心原子硫原子的价层电子对数为
| 6+0 |
| 2 |
C、[Cu(NH3)2]2+的中心原子采用sp杂化,形成两个杂化轨道,与两个氨分子形成两个配位键,中心原子无孤电子对,所以分子的空间构型为直线型,据此判断;
D、配位数为4的配合物可以为正四面体结构,也可以为平面四边形结构,据此判断;
解答:
解:A、当中心原子的配位数为6时,根据价层电子对互斥理论,形成的配合单元常呈八面体空间结构,这样的分布配位键间的作用力最小,物质最稳定,故A正确;
B、SO3中中心原子硫原子的价层电子对数为
=3,中心原子没有孤电子对,所以分子的空间构型为平面正三角形,故B正确;
C、[Cu(NH3)2]2+的中心原子采用sp杂化,形成两个杂化轨道,与两个氨分子形成两个配位键,中心原子无孤电子对,所以分子的空间构型为直线型,故C正确;
D、配位数为4的配合物可以为正四面体结构,也可以为平面四边形结构,故D错误;
故选D.
B、SO3中中心原子硫原子的价层电子对数为
| 6+0 |
| 2 |
C、[Cu(NH3)2]2+的中心原子采用sp杂化,形成两个杂化轨道,与两个氨分子形成两个配位键,中心原子无孤电子对,所以分子的空间构型为直线型,故C正确;
D、配位数为4的配合物可以为正四面体结构,也可以为平面四边形结构,故D错误;
故选D.
点评:本题主要考查配位单元及分子的空间构型,难度中等,解题关键是要注意正确运用价层电子互斥理论分析问题.

练习册系列答案
相关题目
下列表示物质结构的化学用语或说法中,正确的是( )
A、8个中子的碳原子的核素符号:
| ||
B、HF的电子式: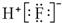 | ||
C、次氯酸的电子式: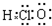 | ||
| D、CCl4分子的每个原子都满足8电子稳定结构 |
下列说法正确的是( )
| A、非金属元素都是主族元素 |
| B、主族元素的次外层电子数都是8 |
| C、稀有气体元素都是非金属元素 |
| D、主族元素都是短周期元素 |
NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A、78g Na2O2固体中含有的阴阳离子总数为3NA |
| B、1mol?L-1 NaOH溶液中含有NA个Na+ |
| C、标准状况下,2.24L CCl4中含有的C-Cl键的数目为0.4NA |
| D、常温常压下,4.4g CO2和N2O混合物中所含有的原子数为0.3NA |
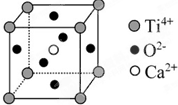 下列关于晶体的说法一定正确的是( )
下列关于晶体的说法一定正确的是( )CaTiO3的晶体结构模型(Ca2+、O2-、Ti4+分别位于立方体的体心、面心和顶点)
| A、1mol NH3中含有电子数为8mol |
| B、常温常压下,12g金刚石中含有2mol C-C键 |
| C、SiO2晶体中每个硅原子与2个氧原子以共价键相结合 |
| D、CaTiO3晶体中每个Ti4+与12个O2-相紧邻 |
根据元素周期律特点,Na、Mg、Al三种元素从左到右描述正确的是( )
| A、金属性依次增强 |
| B、最外层电子数依次增多 |
| C、原子半径依次增大 |
| D、最高正价依次减小 |
通过下列反应:①分解反应、②化合反应、③置换反应、④复分解反应,不能得到单质的是( )
| A、只有② | B、②和④ |
| C、①和③ | D、只有④ |
某温度下在一容积可变的容器中,反应3A(g)+B(g)?C(g),达到平衡后A、B、C的物质的量分别为6mol、2mol和6mol,保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是( )
| A、均加倍 |
| B、均减半 |
| C、均增加1mol |
| D、均减少1mol |
某研究性学习小组为了评价当地雨水的酸度(酸性强弱),选用下列检测试剂,正确的是( )
| A、PH值试纸 |
| B、酚酞试液 |
| C、淀粉碘化钾试纸 |
| D、红色石蕊 |