题目内容
下列叙述正确的是( )
| A、主族元素的最高正价等于该元素原子的核外电子数 |
| B、非金属元素的最高正价与最低负价的和等于8 |
| C、元素的原子失去电子后显负价 |
| D、主族元素的最高正价等于该元素所处的族序数(O、F元素除外) |
考点:原子结构与元素周期律的关系
专题:元素周期律与元素周期表专题
分析:A.主族元素的最高正价等于该元素原子的最外层电子数(O、F除外);
B.主族元素中,非金属元素的最高正价与最低负价的绝对值之和为8(O、F元素除外);
C.元素的原子失去电子后可能显正价;
D.主族元素中,元素的最高正价等于该元素所处的族序数(O、F元素除外).
B.主族元素中,非金属元素的最高正价与最低负价的绝对值之和为8(O、F元素除外);
C.元素的原子失去电子后可能显正价;
D.主族元素中,元素的最高正价等于该元素所处的族序数(O、F元素除外).
解答:
解:A.主族元素的最高正价等于该元素原子的最外层电子数(O、F除外),与其核外电子数多少无关,故A错误;
B.主族元素中,非金属元素的最高正价与最低负价的绝对值之和为8(O、F元素除外),O、F元素没有正化合价,故B错误;
C.元素的原子失去电子后,原子核所带电荷大于核外电子所带电荷,所以显正价,故C错误;
D.主族元素中,元素的最高正价等于该元素所处的族序数(O、F元素除外),O、F元素没有最高正化合价,故D正确;
故选D.
B.主族元素中,非金属元素的最高正价与最低负价的绝对值之和为8(O、F元素除外),O、F元素没有正化合价,故B错误;
C.元素的原子失去电子后,原子核所带电荷大于核外电子所带电荷,所以显正价,故C错误;
D.主族元素中,元素的最高正价等于该元素所处的族序数(O、F元素除外),O、F元素没有最高正化合价,故D正确;
故选D.
点评:本题考查了主族元素化合价与原子最外层电子数、元素族序数的关系,注意规律中的特殊情况,题目难度不大.

练习册系列答案
 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案
相关题目
下列表述正确的是( )
| A、醛基的结构简式-COH |
B、聚丙烯的结构简式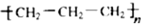 |
C、四氯化碳分子的电子式 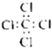 |
D、丙烷分子的球棍模型 |
可以验证硫元素的非金属性比氯元素弱的事实是( )
①硫和氢气在加热条件下能形成H2S、H2S受热300℃左右分解.氯气和氢气在点燃或光照下生成 氯化氢,氯化氢很难分解
②向氢硫酸溶液中滴入氯水有单质硫生成
③硫、氯气分别与铜和铁反应产物是FeS、Cu2S、FeCl3、CuCl2
④高氯酸(HClO4)的酸性强于硫酸.
①硫和氢气在加热条件下能形成H2S、H2S受热300℃左右分解.氯气和氢气在点燃或光照下生成 氯化氢,氯化氢很难分解
②向氢硫酸溶液中滴入氯水有单质硫生成
③硫、氯气分别与铜和铁反应产物是FeS、Cu2S、FeCl3、CuCl2
④高氯酸(HClO4)的酸性强于硫酸.
| A、①②③④ | B、只有①② |
| C、只有②③④ | D、只有③④ |
下列说法正确的是( )
| A、非金属元素都是主族元素 |
| B、主族元素的次外层电子数都是8 |
| C、稀有气体元素都是非金属元素 |
| D、主族元素都是短周期元素 |
在2L密闭容器中,在一定条件下发生A(g)+3B(g)?2C(g),在10s内反应物A的浓度由1mol/L降到0.4mol/L,则ν(C)为( )
| A、0.06mol/(L?s) |
| B、0.12mol/(L?s) |
| C、0.6mol/(L?s) |
| D、1.2mol/(L?s) |
NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A、78g Na2O2固体中含有的阴阳离子总数为3NA |
| B、1mol?L-1 NaOH溶液中含有NA个Na+ |
| C、标准状况下,2.24L CCl4中含有的C-Cl键的数目为0.4NA |
| D、常温常压下,4.4g CO2和N2O混合物中所含有的原子数为0.3NA |
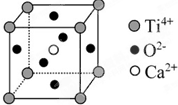 下列关于晶体的说法一定正确的是( )
下列关于晶体的说法一定正确的是( )CaTiO3的晶体结构模型(Ca2+、O2-、Ti4+分别位于立方体的体心、面心和顶点)
| A、1mol NH3中含有电子数为8mol |
| B、常温常压下,12g金刚石中含有2mol C-C键 |
| C、SiO2晶体中每个硅原子与2个氧原子以共价键相结合 |
| D、CaTiO3晶体中每个Ti4+与12个O2-相紧邻 |
通过下列反应:①分解反应、②化合反应、③置换反应、④复分解反应,不能得到单质的是( )
| A、只有② | B、②和④ |
| C、①和③ | D、只有④ |
要除去混在石英中的少量碳酸钙,应采取的方法是( )
| A、加水溶解后,过滤分离 |
| B、加稀盐酸溶解后,过滤分离 |
| C、加NaOH溶液溶解后,过滤分离 |
| D、用酒精灯加热 |