题目内容
下列微粒半径大小比较正确的是:
| A.Na+<Mg2+<Al3+<O2- | B.S2->Cl->Na+>Al3+ |
| C.Na<Mg<Al<S | D.Ca<Rb<K<Na |
B
解析试题分析:A.Na+、Mg2+、Al3+、O2-的电子层结构相同。对于电子层结构相同的微粒来说,核电荷数越大,微粒的半径就越小。因此离子半径:O2-> Na+> Mg2+> Al3+。错误。B.S2-、Cl-核外都有三个电子层,核电荷数Cl->S2-.核电荷数越大,离子的半径就越小。所以半径S2->Cl-;Na+和Al3+的核外都有两个电子层。核电荷数Al3+>Na+,所以离子半径Na+> Al3+ 。对于电子层结构不同的微粒来说,离子的电子层数越多,离子半径就越大。所以微粒半径S2->Cl->Na+>Al3+。正确。C.对于同一周期的元素来说,元素原子的核电荷数越大,原子半径就越小。因此原子半径Na> Mg > Al > S 。错误。D.Na、K、Rb都是同一主族的元素。原子序数越大,原子核外的电子层数就越多,原子半径越大。Ca、K是同一周期的元素,原子序数越大,原子半径就越小。因此元素的原子半径Rb >K >Ca >Na。错误。
考点:考查微粒半径大小比较的知识。

下列能说明氯元素比硫元素非金属性强的是
①HCl比H2S稳定;
②HClO4酸性比H2SO4强;
③Cl2能与H2S反应生成S;
④Cl原子最外层有7个电子,S原子最外层有6个电子;
⑤Cl2与Fe反应生成FeCl3,S与Fe反应生成FeS;
⑥盐酸是强酸,而氢硫酸是弱酸
| A.①②③④⑤⑥ | B.①②③④⑥ | C.①②③⑤ | D.②④⑥ |
短周期元素X、Y、Z、W、Q的原子序数依次增大,且只有一种金属元素。其中X与W处于同一主族,Z元素原子半径在短周期中最大(稀有气体除外),W、Z之间与W、Q之间原子序数之差相等,五种元素原子最外层电子数之和为21,下列说法正确的是
| A.Y的简单离子半径小于Z的简单离子半径 |
| B.Z最高价氧化物对应的水化物分别与X、Y最高价氧化物对应的水化物反应生成1mol水时所放出的热量相同 |
| C.Q可分别与X、Y、Z、W形成化学键类型相同的化合物 |
| D.Y的气态氢化物在一定条件下可被Q单质氧化 |
下列关于元素周期表和元素周期律的说法错误的是
| A.Li、Na、K元素的原子核外电子层数随着核电荷数的增加而增多 |
| B.第二周期元素从Li到F,非金属性逐渐增强 |
| C.因为Na比K容易失去电子,所以Na比K的还原性强 |
| D.O与S为同主族元素,且O比S的非金属性强 |
下列元素性质的递变规律正确的是( )
| A.原子半径:Be<B<C<N |
| B.第一电离能:B<Be<Mg<Na |
| C.元素的电负性:O>N>P>Si |
| D.气态氢化物的稳定性:NH3<CH4<PH3<SiH4 |
下列分子中所有原子都满足最外层为8个电子结构的是
| A.BF3 | B.CCl4 | C.H2O | D.PCl5 |
下列判断中一定正确的是
| A.若X、Y属于同主族元素,且相对原子质量:X>Y,则X失电子能力比Y强 |
B.若M+和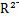 的核外电子层结构相同,则原子半径:R>M 的核外电子层结构相同,则原子半径:R>M |
| C.若X、Y都是气态氢化物,且相对分子质量:X>Y,则酸性:X>Y |
| D.若X、Y是同主族元素,且原子序数:X>Y,则非金属性:X>Y |
短周期元素X、Y、Z、W的原子序数依次增大,X 原子的最外层电子数是其内层电子总数的3 倍,Y 原子的最外层只有2 个电子,Z 单质可制成半导体材料,W与X属于同一主族。下列叙述正确的是
| A.元素W的简单气态氢化物的热稳定性比X 的强 |
| B.元素W 的最高价氧化物对应水化物的酸性比Z 的弱 |
| C.化合物YX、ZX2、WX3中化学键的类型相同 |
| D.原子半径的大小顺序: rY>rZ>rW>rX |