题目内容
下列能说明氯元素比硫元素非金属性强的是
①HCl比H2S稳定;
②HClO4酸性比H2SO4强;
③Cl2能与H2S反应生成S;
④Cl原子最外层有7个电子,S原子最外层有6个电子;
⑤Cl2与Fe反应生成FeCl3,S与Fe反应生成FeS;
⑥盐酸是强酸,而氢硫酸是弱酸
| A.①②③④⑤⑥ | B.①②③④⑥ | C.①②③⑤ | D.②④⑥ |
C
解析试题分析:①利用气态氢化物的稳定性比较非金属性的强弱,正确;②利用最高价含氧酸的酸性的强弱,比较非金属性的强弱,正确;③利用单质之间的置换反应比较非金属性的强弱,正确;④最外层电子数目的多少不能判断非金属性的强弱,错误;⑤与同种单质反应,生成物中元素化合价的不同,可以判断非金属性的强弱,正确;⑥氢化物的水溶液的酸性不能比较非金属性的强弱,错误,答案选C。
考点:考查非金属性强弱判断的依据

练习册系列答案
相关题目
下列排列顺序不正确的是( )
| A.热稳定性:CH4>SiH4>HF | B.原子半径:Na>Mg>O |
| C.酸性:HClO4>H2SO4>H3PO4 | D.非金属性:F>Cl>Br |
短周期主族元素X、Y、Z、W 的原子序数依次增大, X、Y、Z原子序数之和是W的2倍,X、Z在周期表中的相对位置如图所示,X的最低负价绝对值与其原子最外层电子数相等。下列说法正确的是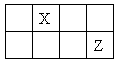
| A.原子半径: r(Y)> r (Z)> r (W) |
| B.Y、Z、W的简单离子的电子层结构相同 |
| C.XWm与YWn中化学键类型相同(m、n为正整数) |
| D.元素Z 的简单气态氢化物的热稳定性比W 的强 |
已知X、Y、Z、W、R是原子序数依次增大的短周期主族元素,X是原子半径最小的元素,Y的最高正价与最低负价的代数和为0,Z的二价阳离子与氖原子具有相同的核外电子排布,W原子最外层电子数是最内层电子数的3倍。下列说法正确的是
| A.R的原子半径比Z的大 |
| B.R的氢化物的热稳定性比W的强 |
| C.X与Y形成的化合物只有一种 |
| D.Y的最高价氧化物的水化物的酸性比W的 |
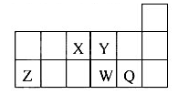
短周期元素X、Y、W、Q在元素周期表中的相对位置如图所示.常温下,Al能溶于W的最高价氧化物的水化物的稀溶液,却不溶于其浓溶液.下列说法正确的是( )
| A.Y的最高化合价为+6 |
| B.离子半径:W>Q>Y>X |
| C.氢化物的沸点:Y>Q |
| D.最高价氧化物的水化物的酸性:W>Q |
元素R的最高价含氧酸分子式为HnRO2n -2 ,则在气态氢化物中,R元素的化合价为
| A.3n-12 | B.3n-6 | C.3n-4 | D.2n-4 |
下列微粒半径大小比较正确的是:
| A.Na+<Mg2+<Al3+<O2- | B.S2->Cl->Na+>Al3+ |
| C.Na<Mg<Al<S | D.Ca<Rb<K<Na |
下列叙述正确的是
| A.正戊烷与异戊烷互为同系物 |
| B.不同元素的原子形成的分子只含极性共价键 |
C.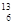 C和 C和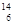 C是中子数不同质子数相同的同种核素 C是中子数不同质子数相同的同种核素 |
| D.短周期第IA与ⅦA族元素既可以形成离子化合物,也可以形成共价化合物 |