题目内容
下列关于元素周期表和元素周期律的说法错误的是
| A.Li、Na、K元素的原子核外电子层数随着核电荷数的增加而增多 |
| B.第二周期元素从Li到F,非金属性逐渐增强 |
| C.因为Na比K容易失去电子,所以Na比K的还原性强 |
| D.O与S为同主族元素,且O比S的非金属性强 |
C
解析试题分析:A、Li、Na、K元素属于同主族元素,随核电荷数的增加电子层数增多,正确;B、同周期元素从左到右,非金属性逐渐增强,正确;C、K的电子层数大于Na的电子层数,所以K比Na易失电子,则K的还原性比Na强,错误;D、O、S最外层都是6个电子,都是第六主族元素,同主族元素从上到下非金属性逐渐减弱,所以O比S的非金属性强,正确,答案选C。
考点:考查元素周期表与元素周期律的关系

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
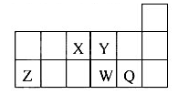
短周期主族元素X、Y、Z、W 的原子序数依次增大, X、Y、Z原子序数之和是W的2倍,X、Z在周期表中的相对位置如图所示,X的最低负价绝对值与其原子最外层电子数相等。下列说法正确的是
| A.原子半径: r(Y)> r (Z)> r (W) |
| B.Y、Z、W的简单离子的电子层结构相同 |
| C.XWm与YWn中化学键类型相同(m、n为正整数) |
| D.元素Z 的简单气态氢化物的热稳定性比W 的强 |
对充有氖气的霓虹灯管通电,灯管发出红色光。产生这一现象的主要原因( )
| A.在电流的作用下,氖原子与构成灯管的物质发生反应 |
| B.电子由基态向激发态跃迁时吸收除红光以外的光线 |
| C.氖原子获得电子后转变成发出红光的物质 |
| D.电子由激发态向基态跃迁时以光的形式释放能量 |
如图为元素周期表中短周期的一部分,四种元素均为非稀有气体元素。下列关于这四种元素及其化合物的说法中正确的是( ) 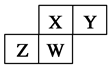
| A.原子半径:W>Z>Y>X |
| B.气态氢化物的稳定性:Z>W>X>Y |
| C.W的最高正化合价与负化合价的绝对值可能相等 |
| D.Z的最高价氧化物的水化物可能为强碱 |
下列微粒半径大小比较正确的是:
| A.Na+<Mg2+<Al3+<O2- | B.S2->Cl->Na+>Al3+ |
| C.Na<Mg<Al<S | D.Ca<Rb<K<Na |
元素在周围表中的位置,反映了元素的原子结构和元素的性质,下列说法正确的是( )
| A.同一元素不可能既表现金属性,又表现非金属性 |
| B.第三周期主族元素的最高正化合价等于它所处的主族序数 |
| C.短周期元素形成离子后,最外层都达到8电子稳定结构 |
| D.同一主族的元素的原子,最外层电子数相同,化学性质完全相同 |
短周期元素甲、乙、丙、丁的原子序数依次增大,甲和乙形成的气态化合物的水溶液呈碱性,乙位于第VA族,甲和丙同主族,丁原子最外层电子数与电子层数相等,则
| A.原子半径:丙>丁>乙 |
| B.单质的还原性:丁>丙>甲 |
| C.甲、乙、丙的氧化物均为共价化合物 |
| D.乙、丙、丁的最高价氧化物对应的水化物不能相互反应 |
下列有关元素的性质及其递变规律正确的是
| A.ⅠA族与ⅦA族元素间可形成共价化合物或离子化合物 |
| B.第二周期元素从左到右,最高正价从+1递增到+7 |
| C.同主族元素的简单阴离子还原性越强,水解程度越大 |
| D.同周期金属元素的化合价越高,其原子失电子能力越强 |