题目内容
下列元素性质的递变规律正确的是( )
| A.原子半径:Be<B<C<N |
| B.第一电离能:B<Be<Mg<Na |
| C.元素的电负性:O>N>P>Si |
| D.气态氢化物的稳定性:NH3<CH4<PH3<SiH4 |
C
解析试题分析:A.Be、B、C、N但是第二周期的元素。原子序数逐渐增大。同一周期的元素,原子序数越大,原子半径就越小。所以原子半径:Be> B>C >N。错误。B.一般情况下,同一周期的元素,原子序数越大,第一电离能就越大。原子序数B >Be。Mg>Na[第一电离能:B>Be;Mg>Na[错误。。C.同一周期的元素,原子序数越大,元素的非金属性就越强,元素的电负性就越大,所以元素的电负性:O>N; P>Si。对于同一主族的元素来说,从上到下,元素的原子半径逐渐增大,元素的非金属性逐渐减弱,四元素的电负性就越小。因此N>P。故元素的电负性:O>N>P>Si。正确。D.元素的非金属性越强,其对应的气态氢化物的稳定性就越强。元素的非金属性N>P>C>Si,所以气态氢化物的稳定性:NH3> PH3>CH4>SiH4。错误。
考点:考查元素的原子半径、第一电离能、电负性、气态氢化物的稳定性的比较的知识。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
已知X、Y、Z、W、R是原子序数依次增大的短周期主族元素,X是原子半径最小的元素,Y的最高正价与最低负价的代数和为0,Z的二价阳离子与氖原子具有相同的核外电子排布,W原子最外层电子数是最内层电子数的3倍。下列说法正确的是
| A.R的原子半径比Z的大 |
| B.R的氢化物的热稳定性比W的强 |
| C.X与Y形成的化合物只有一种 |
| D.Y的最高价氧化物的水化物的酸性比W的 |
对充有氖气的霓虹灯管通电,灯管发出红色光。产生这一现象的主要原因( )
| A.在电流的作用下,氖原子与构成灯管的物质发生反应 |
| B.电子由基态向激发态跃迁时吸收除红光以外的光线 |
| C.氖原子获得电子后转变成发出红光的物质 |
| D.电子由激发态向基态跃迁时以光的形式释放能量 |
下列各组物质的性质比较,正确的是
| A.酸性:HClO4>H3PO4>H2SO4 |
| B.氢化物稳定性:H2S>HF>H2O |
| C.碱性:Al(OH)3>Mg(OH)2>NaOH |
| D.氧化性:F2 > Cl2 > Br2 > I2 |
下列微粒半径大小比较正确的是:
| A.Na+<Mg2+<Al3+<O2- | B.S2->Cl->Na+>Al3+ |
| C.Na<Mg<Al<S | D.Ca<Rb<K<Na |
下列说法中,不符合ⅦA族元素性质特征的是
| A.从上到下原子半径逐渐减小 | B.易形成-1价离子 |
| C.最高价氧化物的水化物显酸性 | D.从上到下氢化物的稳定性依次减弱 |
已知16S、34Se位于同一主族,下列关系正确的是
| A.热稳定性:H2Se> H2S> HCl | B.原子半径:Se>P>Si |
| C.酸性:H3PO4>H2SO4>H2SeO4 | D.还原性:Se2->Br->Cl- |
.我国稀土资源丰富。下列有关稀土元素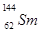 与
与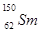 的说法正确的是
的说法正确的是
A.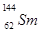 与 与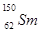 互为同位素 互为同位素 |
B.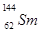 与 与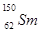 的质量数相同 的质量数相同 |
C.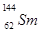 与 与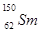 是同一种核素 是同一种核素 |
D.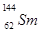 与 与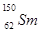 的核外电子数和中子数均为62 的核外电子数和中子数均为62 |
X、Y、Z、W均为短周期元素,它们在周期表中的位置如图所示。已知Y原子的最外层电子数是次外层电子数的3倍,下列说法中正确的是( )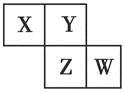
| A.原子半径:W>Z>Y>X |
| B.最高价氧化物对应水化物的酸性:Z>W>X |
| C.氢化物的稳定性:X>Y>Z |
| D.四种元素的单质中,Z单质的熔、沸点最高 |