题目内容
11.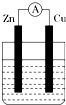 如图所示装置,烧杯中盛有200mL 1mol•L-1的CuSO4溶液.
如图所示装置,烧杯中盛有200mL 1mol•L-1的CuSO4溶液.(1)负极为Zn,电极反应式为Zn-2e-=Zn2+.正极电极反应式为Cu2++2e-=Cu.
(2)若初始时Zn片与Cu片质量相等,实验结束后,称得两极质量差为12.9g,则反应中转移电子的物质的量为0.2mol,反应后溶液中CuSO4的物质的量浓度为0.5mol/L(忽略溶液体积的变化).
分析 (1)该装置是原电池,Zn易失电子作负极、Cu作正极,负极反应式为Zn-2e-=Zn2+、正极反应式为Cu2++2e-=Cu;
(2)负极上锌逐渐溶解、正极上析出Cu,所以两极质量差等于溶解锌的质量和析出铜的质量之和,再结合转移电子相等进行计算;根据原子守恒计算硫酸锌、硫酸铜浓度.
解答 解:(1)该装置是原电池,Zn易失电子作负极、Cu作正极,负极上锌失电子发生氧化反应生成锌离子,所以负极反应式为Zn-2e-=Zn2+、正极上铜离子得电子发生还原反应生成Cu,所以正极反应式为Cu2++2e-=Cu,故答案为:Zn;Zn-2e-=Zn2+;Cu2++2e-=Cu;
(2)负极上锌逐渐溶解、正极上析出Cu,所以两极质量差等于溶解锌的质量和析出铜的质量之和,设溶解锌的物质的量为xmol,根据转移电子守恒知析出Cu的物质的量为xmol,(65+64)g/mol×xmol=12.9g,x=0.1,所以转移电子的物质的量=0.1mol×2=0.2mol;
溶解锌的物质的量为0.1mol、析出Cu的物质的量为0.1mol,则溶液中还剩余硫酸铜的物质的量为0.2L×1mol/L-0.1mol=0.1mol,根据原子守恒知,溶液中c(ZnSO4)=c(CuSO4)=$\frac{0.1mol}{0.2L}$=0.5mol/L,
故答案为:0.2mol;0.5mol/L.
点评 本题考查了原电池原理,明确正负极上发生的反应再结合转移电子守恒进行解答,注意:两个电极质量差不是溶解锌和析出铜的质量差而是二者之和,为易错点.

练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
1.现有六种元素,其中A、B、C、D为短周期主族元素,E、F为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题.
(1)A基态原子中能量最高的电子,其电子云在空间有3个方向,原子轨道呈纺锤形.
(2)某同学根据上述信息,所画的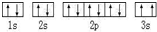 B电子排布图如图,违背了泡利原理.
B电子排布图如图,违背了泡利原理.
(3)CD3中心原子的杂化方式为sp3,分子立体构型三角锥形形.
(4)E元素基态原子的电子占用15个原子轨道,有26种不同运动状态.
(5)F元素的元素符号为As,其基态原子的核外电子排布式1s22s22p63s23p63d104s24p3.
| A元素原子的核外p电子总数比s电子总数少1 |
| B元素原子核外s电子总数与p电子总数相等,且不与A元素在同一周期 |
| C原子核外所有p轨道全满或半满 |
| D元素的主族序数与周期数的差为4 |
| E元素的+3价离子有5个未成对电子 |
| F在周期表的第15列 |
(2)某同学根据上述信息,所画的
 B电子排布图如图,违背了泡利原理.
B电子排布图如图,违背了泡利原理.(3)CD3中心原子的杂化方式为sp3,分子立体构型三角锥形形.
(4)E元素基态原子的电子占用15个原子轨道,有26种不同运动状态.
(5)F元素的元素符号为As,其基态原子的核外电子排布式1s22s22p63s23p63d104s24p3.
19.0.5mol K2SO4中所含的K+离子数为( )
| A. | 3.01×1023 | B. | 6.02×1023 | C. | 0.5 | D. | 1 |
6.等质量的下列物质中,所含原子数目最多的是( )
| A. | Cl2 | B. | HCl | C. | NH3 | D. | H2SO4 |
3.工业上获得大量的乙烯、丙烯、丁二烯所采用的方法是( )
| A. | 聚乙烯 | B. | 聚丁二烯 | C. | 石油裂化 | D. | 石油裂解 |