题目内容
12.下列表达方式错误的是( )| A. | CO2的分子模型示意图: | |
| B. | 甲烷的电子式  | |
| C. | 硫离子的核外电子排布式 1s22s22p63s23p6 | |
| D. | 碳-12原子构成${\;}_{6}^{12}$C |
分析 A.二氧化碳分子中存在两个碳氧双键,为直线型结构,不是V型结构;
B.甲烷中存在4个碳氢键,碳原子最外层达到8电子稳定结构;
C.硫离子核外电子总数为18,根据核外电子排布式的书写原则判断;
D.碳元素的质子数为6,碳-12原子的质量数为12.
解答 解:A.二氧化碳分子为直线型结构,正确的比例模型为 ,故A错误;
,故A错误;
B.甲烷为共价化合物,甲烷分子中存在4个碳氢共价键,甲烷的电子式为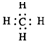 ,故B正确;
,故B正确;
C.硫离子结构示意图为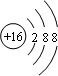 ,则硫离子的核外电子排布式为1s22s22p63s23p6,故C正确;
,则硫离子的核外电子排布式为1s22s22p63s23p6,故C正确;
D.碳-12原子的质子数为6,质量数为12,该碳原子可以表示为${\;}_{6}^{12}$C,故D正确;
故选A.
点评 本题考查了比例模型、电子式、核外电子排布式、原子符号的表示方法等知识,题目难度中等,注意掌握常见化学用语的表示方法,能够正确书写常见粒子的电子排布式.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
3.工业上获得大量的乙烯、丙烯、丁二烯所采用的方法是( )
| A. | 聚乙烯 | B. | 聚丁二烯 | C. | 石油裂化 | D. | 石油裂解 |
7.实验室可用于检验葡萄糖的试剂是( )
| A. | NaOH溶液 | B. | 盐酸 | C. | 碘水 | D. | 银氨溶液 |
17.常温常压下一瓶气体中只含有O元素,通常情况下这瓶气体不可能是( )
| A. | 化合物 | B. | 混合物 | C. | 纯净物 | D. | 单质 |
4.下列说法正确的是( )
| A. | 非金属氧化物都是酸性氧化物 | |
| B. | 一种元素可以组成单质,也可以组成混合物 | |
| C. | 电解质电离时生成的阳离子含有氢离子的化合物叫酸 | |
| D. | 碱性氧化物一定是金属氧化物 |
9.人体血液里存在如下平衡:CO2+H2O?H2CO3$?_{H+}^{OH-}$HCO${\;}_{3}^{-}$,使人体血液pH值保持在7.35~7.45之间,否则就会发生酸中毒或碱中毒.其pH值随c(HCO3-):c(H2CO3) 变化关系如下表所示,则下列说法中,正确的是( )
| c(HCO3-):c(H2CO3) | 1.0 | 17.8 | 20.0 | 22.4 |
| pH | 6.10 | 7.35 | 7.40 | 7.45 |
| A. | 正常人体血液中,HCO3-的水解程度小于电离程度 | |
| B. | 人体发生酸中毒时,可饮用碳酸饮料缓解 | |
| C. | pH=7.00的血液中,c(H2CO3)=c(HCO3-) | |
| D. | 常温下pH=7.40的血液稀释至pH=7.35,c(H+)•c(OH-) 一定不变 |