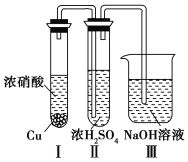
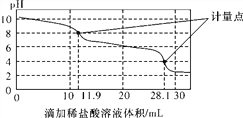
题目内容
【题目】大力发展电动汽车,可以有效控制空气污染。目前机动车常使用的电池有铅蓄电池、锂电池等。
I.铅蓄电池充放电的总反应为:PbO2+Pb+2H2SO4 ![]() 2PbSO4+2H2O,锂硫电池充放电的总反应为:2Li+S
2PbSO4+2H2O,锂硫电池充放电的总反应为:2Li+S![]() Li2S。
Li2S。
(1)82Pb的原子结构示意图为 。铅蓄电池的正极材料为_________。
(2)当消耗等质量的负极活性物质时,锂硫电池的理论放电量是铅蓄电池的 ____倍。(保留三位有效数字)。
(3)古代用PbSO4作油画的白色颜料,置于空气会慢慢变成黑色的PbS,从而使油画色彩变暗。用H2O2清洗可使油画“复原”。用化学方程式表示该复原的原理________。
II.由方铅矿(PbS)制备铅蓄电池电极材料(PbO2)的方法如下:
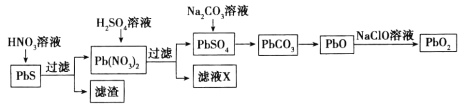
(4)滤液X是一种可循环使用的物质,其溶质主要是__________________(填化学式),若X中残留的![]() 过多,循环使用时可能出现的问题是___________________________。
过多,循环使用时可能出现的问题是___________________________。
(5)向 PbSO4中加Na2CO3溶液会发生:PbSO4 (s)+ ![]() (aq)
(aq)![]() PbCO3 (s)+
PbCO3 (s)+ ![]() (aq)。已知25℃时,Ksp(PbSO4)= 1.8×10-8,Ksp(PbCO3)=1.5×10-13。列式并计算该反应此温度下的平衡常数K 。(提示:需写出K的表达式、代入数据、算出结果)
(aq)。已知25℃时,Ksp(PbSO4)= 1.8×10-8,Ksp(PbCO3)=1.5×10-13。列式并计算该反应此温度下的平衡常数K 。(提示:需写出K的表达式、代入数据、算出结果)
(6)以石墨为电极电解Pb(NO3)2溶液也可以制得PbO2。PbO2将在 极生成(填“阴”或“阳”);而另一极的电极反应式为 ,故Pb元素的利用率较低。若在Pb(NO3)2溶液中加入适量Cu(NO3)2则可有效利用Pb2+,其理由是___________________。
【答案】(1) PbO2
PbO2
(2)14.8
(3)PbS+ 4H2O2![]() PbSO4+4H2O
PbSO4+4H2O
(4)HNO3 方铅矿在被浸出时会部分转化成PbSO4随滤渣排除,损失铅元素
(5)K=![]() =
=![]() = 1.2×105
= 1.2×105
(6)阳 Pb2++2e ![]() Pb
Pb
Cu2+优先Pb2+在阴极放电,从而提高Pb2+转变为PbO2的利用率
【解析】本题主要考查原电池原和电解池的综合应用。
(1)Pb与C同属IV A,82Pb的原子结构示意图为 。铅蓄电池的正极材料为PbO2。
。铅蓄电池的正极材料为PbO2。
![]()
当消耗等质量的负极活性物质时,锂硫电池的理论放电量是铅蓄电池的![]() =14.8倍。
=14.8倍。
(3)用H2O2清洗可使油画“复原”时,PbS变为PbSO4,H2O2变为H2O,反应的化学方程式为PbS+ 4H2O2![]() PbSO4+4H2O。
PbSO4+4H2O。
(4)滤液X是一种可循环使用的物质,其溶质主要是HNO3,若X中残留的![]() 过多,循环使用时可能出现的问题是方铅矿在被浸出时会部分转化成PbSO4随滤渣排除,损失铅元素。
过多,循环使用时可能出现的问题是方铅矿在被浸出时会部分转化成PbSO4随滤渣排除,损失铅元素。
(5)K=![]() =
=![]() =
=![]() =1.2×105。
=1.2×105。
(6)PbO2将在阳极生成;而另一极的电极反应式为Pb2++2e ![]() Pb,故Pb元素的利用率较低。若在Pb(NO3)2溶液中加入适量Cu(NO3)2则可有效利用Pb2+,其理由是Cu2+优先Pb2+在阴极放电,从而提高Pb2+转变为PbO2的利用率。
Pb,故Pb元素的利用率较低。若在Pb(NO3)2溶液中加入适量Cu(NO3)2则可有效利用Pb2+,其理由是Cu2+优先Pb2+在阴极放电,从而提高Pb2+转变为PbO2的利用率。

 阅读快车系列答案
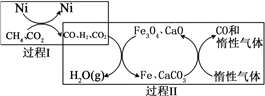
阅读快车系列答案【题目】(1)科学家寻找高效催化剂,通过如下反应实现大气污染物转化:
2CO(g) +2NO(g) ![]() N2(g)+2CO2(g) △H1
N2(g)+2CO2(g) △H1
已知:CO的燃烧热△H2=-283kJ/moL
N2(g) +O2(g) =2NO(g)几种化学键的键能数据如下:
化学键 | N≡N键 | O=O键 | NO中氮氢键 |
键能(kJ/mol) | 945 | 498 | 630 |
求△H1__________________。
(2)NH3作为一种重要化工原料,被大量应用于工业生产,与其有关性质反应的催化剂研究曾被列入国家863计划,在恒温恒容装置中充入一定量的NH3和O2,在某催化剂的作用下进行下述反应I,测得不同时间的NH3和O2的浓度如下表:
时间(min) | 0 | 5 | 10 | 15 | 20 | 25 |
C(NH3)/mol·L-1 | 1.00 | 0.36 | 0.12 | 0.08 | 0. 0072 | 0.0072 |
C(O2)/mol·L-1 | 2.00 | 1.20 | 0.90 | 0.85 | 0.84 | 0.84 |
则下列有关叙述中正确的是______________
A.使用催化剂时,可降低该反应的活化能,加快其反应速率
B. 若测得容器内4v正(NH3)=6v逆(H2O)时,说明反应已达平衡
C.当容器内![]() =1时,说明反应已达平衡
=1时,说明反应已达平衡
D.前10分钟内的平均速率v(NO)=0.088mol·L-1·min-1
<>(3)氨催化氧化时会发生下述两个竞争反应I、II。催化剂常具有较强的选择性,即专一性。已知:反应I 4NH3(g)+5O2(g)![]() 4NO(g) +6H2O(g)
4NO(g) +6H2O(g)
反应 II:4NH3(g)+3O2(g) ![]() 2N2(g) +6H2O(g)
2N2(g) +6H2O(g)
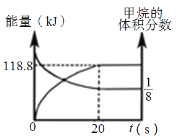
为分析某催化剂对该反应的选择性,在1L密闭容器中充入1 mol NH3和2mol O2,测得有关物质的量关系如图:

①该催化剂在高温时选择反应____________ (填“ I ”或“ II”)。
② 520℃时,4NH3(g)+3O2![]() 4N2(g) +6H2O(g)的平衡常数K=________________ (不要求得出计算结果,只需列出数字计算式)。
4N2(g) +6H2O(g)的平衡常数K=________________ (不要求得出计算结果,只需列出数字计算式)。
③由图像可判断,反应I正反应△H_______________ 0(填“>”、“<”,或“=”)
④C点比B点所产生的NO的物质的量少的主要原因_________________________。
(4)羟胺(NH2OH)的电子式_____________,羟胺是一种还原剂,可用作显像剂还原溴化银生成银单质和氮气,该反应的化学方程式为______________________________。
现用25.00mL0.049mol/L的羟胺的酸性溶液跟足量的硫酸铁溶液在煮沸条件下反应,生成的Fe2+恰好与24.50mL 0.020mol/L的KMnO4酸性溶液完全作用,则在上述反应中,羟胺的氧化产物是_____。