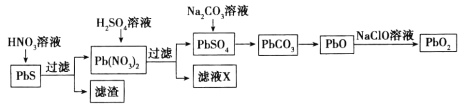
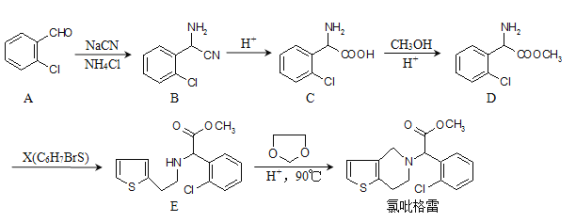
��Ŀ����
����Ŀ����1����ѧ��Ѱ�Ҹ�Ч������ͨ�����·�Ӧʵ�ִ�����Ⱦ��ת����
2CO(g) +2NO(g) ![]() N2(g)+2CO2(g) ��H1
N2(g)+2CO2(g) ��H1
��֪��CO��ȼ���ȡ�H2=-283kJ/moL
N2(g) +O2(g) =2NO(g)���ֻ�ѧ���ļ����������£�
��ѧ�� | N��N�� | O=O�� | NO�е���� |
����(kJ/mol) | 945 | 498 | 630 |
���H1__________________��
��2��NH3��Ϊһ����Ҫ����ԭ�ϣ�������Ӧ���ڹ�ҵ�����������й����ʷ�Ӧ�Ĵ����о������������863�ƻ����ں��º���װ���г���һ������NH3��O2����ij�����������½���������ӦI����ò�ͬʱ���NH3��O2��Ũ�����±���
ʱ�䣨min�� | 0 | 5 | 10 | 15 | 20 | 25 |
C(NH3)/mol��L-1 | 1.00 | 0.36 | 0.12 | 0.08 | 0. 0072 | 0.0072 |
C(O2)/mol��L-1 | 2.00 | 1.20 | 0.90 | 0.85 | 0.84 | 0.84 |
�������й���������ȷ����______________
A.ʹ�ô���ʱ���ɽ��÷�Ӧ�Ļ�ܣ��ӿ��䷴Ӧ����
B. �����������4v��(NH3)=6v��(H2O)ʱ��˵����Ӧ�Ѵ�ƽ��
C.��������![]() =1ʱ��˵����Ӧ�Ѵ�ƽ��
=1ʱ��˵����Ӧ�Ѵ�ƽ��
D.ǰ10�����ڵ�ƽ������v��NO��=0.088mol��L-1��min-1
<>��3����������ʱ�ᷢ����������������ӦI��II�����������н�ǿ��ѡ���ԣ���רһ�ԡ���֪����ӦI 4NH3(g)+5O2(g)![]() 4NO(g) +6H2O(g)
4NO(g) +6H2O(g)
��Ӧ II��4NH3(g)+3O2(g) ![]() 2N2(g) +6H2O(g)
2N2(g) +6H2O(g)
Ϊ����ij�����Ը÷�Ӧ��ѡ���ԣ���1L�ܱ������г���1 mol NH3��2mol O2������й����ʵ�����ϵ��ͼ��

�ٸô����ڸ���ʱѡ��Ӧ____________ (� I ���� II������
�� 520��ʱ��4NH3(g)+3O2![]() 4N2(g) +6H2O(g)��ƽ�ⳣ��K=________________ (��Ҫ��ó���������ֻ���г����ּ���ʽ����
4N2(g) +6H2O(g)��ƽ�ⳣ��K=________________ (��Ҫ��ó���������ֻ���г����ּ���ʽ����
����ͼ����жϣ���ӦI����Ӧ��H_______________ 0���>������<������=����
��C���B����������NO�����ʵ����ٵ���Ҫԭ��_________________________��
��4���ǰ���NH2OH���ĵ���ʽ_____________���ǰ���һ�ֻ�ԭ�����������������ԭ�廯�����������ʺ͵������÷�Ӧ�Ļ�ѧ����ʽΪ______________________________��
����25.00mL0.049mol/L���ǰ���������Һ����������������Һ����������·�Ӧ�����ɵ�Fe2+ǡ����24.50mL 0.020mol/L��KMnO4������Һ��ȫ���ã�����������Ӧ�У��ǰ�������������_____��
���𰸡� -749KJ/mol AD 1 ![]() �� �÷�ӦΪ���ȷ�Ӧ�����¶����ߣ�ƽ�������淴Ӧ���ƶ�
�� �÷�ӦΪ���ȷ�Ӧ�����¶����ߣ�ƽ�������淴Ӧ���ƶ� ![]() 2NH2OH+2AgBr====N2��+2Ag��+2HBr+2H2O N2O
2NH2OH+2AgBr====N2��+2Ag��+2HBr+2H2O N2O
����������1���ʱ�=��Ӧ������ܺ�-����������ܺͣ���Ӧ��N2��g��+O2��g��=2NO��g����H3=945kJ/mol+498kJ/mol-630kJ/mol��2=+183 kJmoL-1��CO��ȼ������H2=-283kJmoL-1����2CO��g��+O2��g��=2CO2��g����H=-566kJ/mol ������-�ٵõ�2CO��g��+2NO��g��N2��g��+2CO2��g��������2CO��g��+2NO��g��N2��g��+2CO2��g������H1=-566kJ/mol-183 kJ/moL=-749kJ/moL����2��A������������ı䷴Ӧ;�������ͷ�Ӧ�Ļ�ܣ������˻���Ӱٷ�������ѧ��Ӧ��������A��ȷ��B�����ڷ�Ӧ4NH3��g��+5O2��g��4NO��g��+6H2O��g����Ӧ�� 6v ����NH3��=4v ����H2O��ʱ����Ӧ�ﵽƽ��״̬��B����C������Ӧ�ﵽƽ��״̬ʱ�����淴Ӧ������ȣ������ʵ�Ũ�ȡ��ٷֺ������䣬�� n(NO)/n(NH3)=1 �أ�C����D.ǰ10���������İ�����0.88mol/L�����ݷ���ʽ��֪����NO��0.88mol/L��ƽ������v��NO��=0.88mol/L��10min��0.088mol��L-1��min-1��D��ȷ����ѡAD����3������ͼ��֪���ô����ڸ���ʱ�����ɵ�NO���ʵ���Զ���ڵ����ģ��ʸô����ڸ�����ѡ��ӦI������ 1L �ܱ������г��� 1mol NH3�� 2mol O2��520��ƽ��ʱn��NO��=n��N2��=0.2mol����
4NH3��g��+5O2��g��4NO��g��+6H2O��g��
�仯��mol �� 0.2 0.25 0.2 0.3
4NH3��g��+3O2��g��2N2��g��+6H2O��g��
�仯��mol �� 0.4 0.3 0.2 0.6
��ƽ��ʱ��n��NH3��=1mol-0.2mol-0.4mol=0.4mol��n��O2��=2mol-0.25mol-0.3mol=1.45mol��n��H2O��=0.3mol+0.6mol=0.9mol�������������Ϊ1L���������ʵ�������Ũ�ȼ���ƽ�ⳣ��K=c2(N2)c6(H2O)/c4(NH3)c3(O2)=0.22��0.96/0.44��1.453 ���۸���ͼ���֪NOŨ�ȴﵽ���ֵ�������¶�NOŨ�Ƚ��ͣ���˵�������¶�ƽ�����淴Ӧ������У��������Ӧ�Ƿ��ȷ�Ӧ����H��0�������ڸ÷�ӦΪ���ȷ�Ӧ�����¶����ߣ�ƽ�������淴Ӧ���ƶ�������C���B����������NO�����ʵ���������4���ǰ���NH2OH���ǹ��ۻ��������8���Ӻ�2�����ȶ��ṹ��֪����ʽΪ![]() ���ǰ���һ�ֻ�ԭ�����������������ԭ�廯�����������ʺ͵��������ݵ��ӵ�ʧ�غ��ԭ���غ��֪�÷�Ӧ�Ļ�ѧ����ʽΪ2NH2OH+2AgBr��N2��+2Ag��+2HBr+2H2O��25.00mL0.049mol/L���ǰ������ʵ�����0.001225mol��KMnO4�����ʵ�����0.00049mol�����ݵ��ӵ�ʧ�غ��֪1�����ǰ�ʧȥ���ӵĸ�����0.00049mol��5/0.001225mol=2����Ԫ�ػ��ϼ۴ӣ�1�����ߵ���1�ۣ������ǰ�������������N2O��
���ǰ���һ�ֻ�ԭ�����������������ԭ�廯�����������ʺ͵��������ݵ��ӵ�ʧ�غ��ԭ���غ��֪�÷�Ӧ�Ļ�ѧ����ʽΪ2NH2OH+2AgBr��N2��+2Ag��+2HBr+2H2O��25.00mL0.049mol/L���ǰ������ʵ�����0.001225mol��KMnO4�����ʵ�����0.00049mol�����ݵ��ӵ�ʧ�غ��֪1�����ǰ�ʧȥ���ӵĸ�����0.00049mol��5/0.001225mol=2����Ԫ�ػ��ϼ۴ӣ�1�����ߵ���1�ۣ������ǰ�������������N2O��