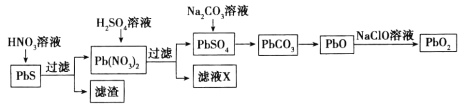
题目内容
【题目】实验室使用pH传感器来测定Na2CO3和NaHCO3混合物中NaHCO3的含量。称取1.59 g样品,溶于水配成250.00 mL溶液,取出该溶液25.00 mL用0.1 mol·L-1盐酸进行滴定,得到如下曲线。以下说法或操作正确的是( )
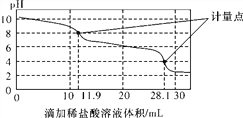
A. 上一个计量点前发生反应的离子方程式为HCO(+H+===H2O+CO2↑
B. 下一个计量点溶液中存在大量的阴离子是Cl-、HCO(
C. 此样品n(NaHCO3)=(28.1-2×11.9)×10-4 mol
D. 使用该方法测定Na2CO3和NaOH混合溶液中的氢氧化钠含量,将会得到1个计量点
【答案】C
【解析】A.根据图示知道上一个计量点前溶液显示碱性,发生的离子反应:CO32-+H+═HCO3-,故A错误;B.下一个计量点溶液pH=4,显示酸性,不能存在HCO3-离子,故B错误;C.Na2CO3和NaHCO3混合物加盐酸,首先是碳酸钠转化为碳酸氢钠:CO32-+H+═HCO3-,此时消耗的盐酸的体积为11.9mL,随后是碳酸氢钠转化为氯化钠的过程,HCO3-+H+═H2O+CO2↑,由于CO32-+H+═HCO3-过程和HCO3-+H+═H2O+CO2过程消耗的盐酸体积应该是相同的,所以样品中碳酸钠消耗的盐酸为2×11.9mL,则样品中碳酸氢钠消耗的盐酸n(HCl)=(28.1-2×11.9)×10-3L×0.1molL-1=(28.1-2×11.9)×10-4mol,所以此样品n(NaHCO3)=(28.1-2×11.9)×10-4mol×10=(28.1-2×11.9)×10-3mol,故C正确;D.Na2CO3和NaOH混合溶液中加入盐酸,先是和氢氧化钠中和,随后是和碳酸钠之间发生反应,生成碳酸氢钠,最后是生成氯化钠,不止得到1个计量点,是3个计量点,故D错误;故选C。