题目内容
【题目】短周期元素形成的纯净物A、B、C、D、E,五种物质之间的转化关系如图所示,物质A与物质B之间的反应不在溶液中进行(E可能与A、B两种物质中的一种相同)。

请回答下列问题:
(1)若C是离子化合物,D是一种强碱,则C的化学式________,并任写一种C的主要用途 。
(2)若E的水溶液呈弱酸性,D是既能溶于强酸、又能溶于强碱的化合物。
①用电离方程式解释D既能溶于强酸、又能溶于强碱的原因(仅写出电离方程式即可): ________________________。
②用电荷守恒的等式表示E与NaOH溶液反应生成正盐的溶液中所有离子的浓度之间的关系:________________________________。
(3)若C是一种气体,D是一种强酸,则:
①C与水反应的化学方程式为_____________________________________。
②已知常温下物质A与物质B反应生成1 mol气体C的ΔH=-57 kJ·mol-1,1 mol气体C与H2O反应生成化合物D和气体E的ΔH=-46 kJ·mol-1,写出物质A与物质B及水反应生成化合物D的热化学方程式为__________________________________________。
③有人认为“浓H2SO4可以干燥气体C”。某同学为了验证该观点是否正确,用如图所示装置进行实验。
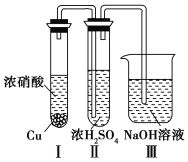
实验过程中,在浓H2SO4中未发现有气体逸出,则得出的结论是____________________________。
④用铂做电极电解H2SO4的溶液,其阳极的电极反应式为 。
【答案】(1)Na2O2 供氧剂、漂白剂、氧化剂均可
(2)①H++H2O+![]()
![]() Al(OH)3
Al(OH)3![]() Al3++3OH-
Al3++3OH-
②c(Na+)+c(H+) =2c(S2-)+c(HS-)+c(OH-)
(3)①3NO2+H2O![]() 2HNO3+NO
2HNO3+NO
②4NO(g)+3O2(g)+2H2O(l) ![]() 4HNO3(aq) ΔH=-618 kJ·mol-1
4HNO3(aq) ΔH=-618 kJ·mol-1
③NO2能溶于浓硫酸中,浓硫酸不能干燥NO2
④2H2O-4e-![]() O2 ↑+4H+
O2 ↑+4H+
【解析】本题考查无机推断,钠的重要化合物的性质,溶液中离子浓度大小的比较,氮的重要化合物的化学性质,热化学方程式的书写,电解原理。
(1)离子化合物与水反应生成气体和碱,C是过氧化钠Na2O2,可以作供氧剂、漂白剂、氧化剂。
(2)若E的水溶液呈弱酸性,D是既能溶于强酸、又能溶于强碱的化合物,化合物C遇水发生双水解,C是硫化铝,水解生成硫化氢气体和氢氧化铝沉淀。
①氢氧化铝是两性氢氧化物,可以按酸式电离Al(OH)3![]() H++H2O+
H++H2O+![]() ,也可以按碱式电离Al(OH)3
,也可以按碱式电离Al(OH)3 ![]() Al3++3OH-。
Al3++3OH-。
②E与NaOH溶液反应生成正盐硫化钠的溶液中所有离子的浓度之间的关系:c(Na+)+c(H+) =2c(S2-)+c(HS-)+c(OH-)
(3)若C是一种气体,D是一种强酸,则:
①C是二氧化氮,与水反应的化学方程式为:3NO2+H2O![]() 2HNO3+NO
2HNO3+NO
②A、B反应生成C的反应方程式为:NO(g)+ ![]() O2
O2![]() NO2(g) ΔH=-57 kJ·mol-1,C与水反应生成D和E的热化学方程式为:NO2(g)+
NO2(g) ΔH=-57 kJ·mol-1,C与水反应生成D和E的热化学方程式为:NO2(g)+![]() H2O(l)
H2O(l) ![]()
![]() HNO3(aq)+
HNO3(aq)+![]() NO(g) ΔH=-46 kJ·mol-1,根据盖斯定律,物质A与物质B及水反应生成化合物D的热化学方程式为:4NO(g)+3O2(g)+2H2O(l)
NO(g) ΔH=-46 kJ·mol-1,根据盖斯定律,物质A与物质B及水反应生成化合物D的热化学方程式为:4NO(g)+3O2(g)+2H2O(l) ![]() 4HNO3(aq) ,ΔH=6(5746)kJ·mol-1=-618 kJ·mol-1
4HNO3(aq) ,ΔH=6(5746)kJ·mol-1=-618 kJ·mol-1
③实验过程中,在浓H2SO4中未发现有气体逸出,说明气体二氧化氮能溶于浓硫酸,浓硫酸不能干燥NO2
④用铂做电极电解H2SO的溶液,其阳极上水放电生成氧气,电极反应式为:2H2O-4e-![]() O2 ↑+4H+。
O2 ↑+4H+。