题目内容
5.下列离子方程式与所述事实相符且正确的是( )| A. | 用食醋和淀粉-KI试纸检验碘盐中的KIO3:IO3-+5I-+6H+═3I2+3H2O | |
| B. | 稀HNO3溶液与难溶于水的FeS固体:FeS+2H+═Fe2++H2S↑ | |
| C. | 碳酸氢钙与少量的NaOH溶液反应 Ca2++HCO3-+OH-═CaCO3↓+H2O | |
| D. | Na与水的反应Na+H2O═Na++OH-+H2↑ |
分析 A.醋酸在离子反应中保留化学式;
B.发生氧化还原反应生成硝酸铁、S、NO和水;
C.反应生成碳酸钙、水、碳酸氢钠;
D.电子、原子不守恒.
解答 解:A.用食醋和淀粉-KI试纸检验碘盐中的KIO3的离子反应为IO3-+5I-+6CH3COOH═6CH3COO-+3I2+3H2O,故A错误;
B.稀HNO3溶液与难溶于水的FeS固体的离子反应为NO3-+FeS+4H+═Fe3++S+2H2O+NO↑,故B错误;
C.碳酸氢钙与少量的NaOH溶液反应的离子反应为Ca2++HCO3-+OH-═CaCO3↓+H2O,故C正确;
D.Na与水的反应的离子反应为2Na+2H2O═2Na++2OH-+H2↑,故D错误;
故选C.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、氧化还原反应的离子反应考查,注意离子反应中保留化学式的物质及电子、电荷守恒分析,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
16.已知①H2SO4比HClO4稳定 ②HClO4比H2SO4酸性强 ③S2-比Cl-易被氧化 ④HCl比H2S稳定 ⑤Cu与HCl不反应,与浓H2SO4反应,其中可以说明氯比硫非金属性强的是( )
| A. | 除①外 | B. | ②③④ | C. | ①②④ | D. | 全部 |
13.设NA代表阿伏加德罗常数,下列叙述正确的是( )
| A. | 20℃时,1mol SO2的体积一定大于22.4L | |
| B. | 常温常压下,1mol CO2与18 g H2O所含有的原子总数均为3 NA | |
| C. | 1mol/LNaCl溶液表示1L水中含有NaCl 58.5g | |
| D. | 标准状况下,11.2L NO与5.6 L O2形成的混合气体中含有的分子数为0.5NA |
17.下列离子在溶液中因发生氧化还原反应而不能大量共存的是( )
| A. | H + NO3- Fe 2+ Na + | B. | Ag + NO3- Cl - K + | ||
| C. | K + Ba 2+ OH - SO42- | D. | Cu 2+ NH4+ Br - OH - |
14.金属元素铊的相关信息如图所示.下列有关卡片信息解读正确的是( )


| A. | 铊元素的质量数是81 | B. | 铊原子的电子数为3 | ||
| C. | 铊原子的相对原子质量是204.4 | D. | 铊的金属性比铝的金属性强 |
2.无水氯化铝是白色晶体,露置在空气中极易水解,在178℃升华,装有无水氯化铝试剂瓶置露空气中,会产生大量白雾,氯化铝常作为有机合成和石油工业的催化剂,并用于处润滑油等.如图是实验室制取少量无水氯化铝装置的仪器和药品.可供选用的试剂如下:
A.食盐晶体 B.水 C.饱和食盐水 D.烧碱溶液 E.铝粉
F.二氧化锰 G.浓硫酸 H.无水CaCl2 I.碱石灰
回答下列问题:
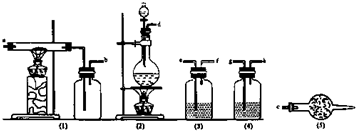
(1)从上述仪器中选取若干连成一制备并保存无水AlCl3的装置,用图中各管口标号按先后可连接为:d接e,f接g,h接a,b接c.
(2)填写连接装置中各选用仪器里应盛放的物质:
(3)写出AlCl3露置在空气中生成白雾的化学方程式AlCl3+3H2O?Al(OH)3+3HCl;为避免上述现象的发生应采取的措施是在装置I后连一干燥装置防空气中水蒸气无水氯化铝反应.
A.食盐晶体 B.水 C.饱和食盐水 D.烧碱溶液 E.铝粉
F.二氧化锰 G.浓硫酸 H.无水CaCl2 I.碱石灰
回答下列问题:

(1)从上述仪器中选取若干连成一制备并保存无水AlCl3的装置,用图中各管口标号按先后可连接为:d接e,f接g,h接a,b接c.
(2)填写连接装置中各选用仪器里应盛放的物质:
| 仪器标号 | 1 | 2 | 3 | 4 | 5 |
| 试剂标号 | E | AFG | C | G | I |
 ):
):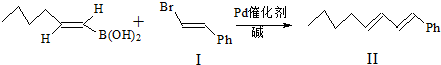
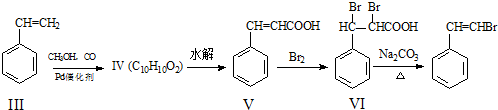
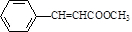 ,化合物V转化为化合物VI的反应类型为加成反应.
,化合物V转化为化合物VI的反应类型为加成反应. .
.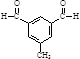 或
或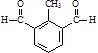 .
. )与化合物(
)与化合物(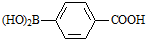 )能发生偶联反应生成一种抗抑郁药物,写出该抗抑郁药物的结构简式
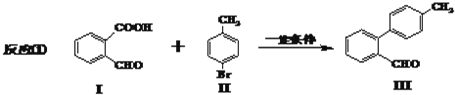
)能发生偶联反应生成一种抗抑郁药物,写出该抗抑郁药物的结构简式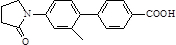 .
.
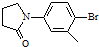
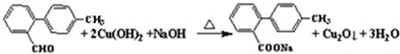 .
. (要求:①能与FeCl3溶液发生显色反应;②苯环上一氯取代产物有2种)
(要求:①能与FeCl3溶液发生显色反应;②苯环上一氯取代产物有2种)