题目内容
20.某校实验小组的同学利用如图所示实验装置探究氨与氧化铜的反应(图中夹持、固定装置部分均略去).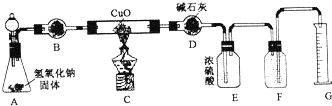
(1)按图设计组装好仪器,先检查装置的气密性,再装入药品.
(2)A中分液漏斗内应装浓氨水 B中固体试剂为碱石灰.
(3)打开分液漏斗活塞,加入试剂,点燃c处的酒精灯,一段时间后,观察到,A中氧化铜全部转化成光亮的红色固体,F中集气瓶内收集到一种无色气态单质.写出装置C中反应的化学方程式:2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2+3H2O
(4)E中浓硫酸的作用是吸收未反应的氨气..
(5)已知Cu2O也是红色的.表为实验前后C装置的质量,通过计算可知反应后的产物中有(填“有’’、“无’’、“无法确定”)Cu2O.
| 空玻璃管 | 实验前(样品+玻璃管) | 实验后(样品+玻璃管) |
| 59.60g | 65.60g | 64.64g |
分析 (1)制备气体,连接好装置后都应该检验装置的气密性;
(2)实验室用浓氨水逐滴滴加到生石灰或者固体氢氧化钠制备氨气,氨气为碱性气体,应选择碱性干燥剂;
(3)氨气与氧化铜反应生成铜和氮气、水;
(4)浓硫酸与氨气反应,吸收氨气;
(5)依据实验数据计算氧化铜质量,结合2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2+3H2O,利用差量法计算氧化铜完全生成铜时质量减少了,对比判断解答.
解答 解:(1)制备氨气,连接好装置后都应该先检验装置的气密性;
故答案为:检查装置的气密性;
(2)A中分液漏斗内应装浓氨水,逐滴滴加到生石灰或者固体氢氧化钠制备氨气,氨气为碱性气体,应选择碱性干燥剂,可以选用碱石灰干燥;
故答案为:浓氨水;碱石灰;
(3)氨气与氧化铜反应生成铜和氮气、水,化学方程式:2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2+3H2O;
故答案为:2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2+3H2O;
(4)E中浓硫酸的作用是吸收氨气;
故答案为:吸收氨气;
(5)有表中数据可知:实验前氧化铜的质量=65.60g-59.60g=6g;实验后固体质量减少量为:65.60g-64.64g=
0.96g;
依据方程式设氧化铜完全反应生成铜消耗的质量为m则:
2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2+3H2O△m
240 48
6g m
解得m=1.2g;
实际质量减少为0.96g,小于1.2g,说明有氧化亚铜生成;
故答案为:有.
点评 本题考查了氨气的制备和性质的检验,明确氨气制备原理及性质是解题关键,题目难度不大.

| A. | 瓷碗破碎 | B. | 铁丝弯曲 | C. | 蜡烛燃烧 | D. | 冰雪融化 |
| A. | 花香四溢--分子在不停运动 | |
| B. | 热胀冷缩--分子的大小随温度变化而改变 | |
| C. | 酒精挥发--分子间距增大 | |
| D. | 氢气和氧气反应生成水--分子发生了变化 |

| A. | 一定条件下,1mol霉酚酸最多可与3molH2反应 | |
| B. | 处于同一平面的碳原子至多9个 | |
| C. | 只有2个官能团 | |
| D. | 分子式为:C17H20O6 |
| A. | 甲苯与硝酸发生取代反应生成三硝基甲苯 | |
| B. | 甲苯能使热的酸性高锰酸钾溶液褪色 | |
| C. | 甲苯燃烧时产生带浓烈黑烟的火焰 | |
| D. | 1mol甲苯最多能与3mol氢气发生加成反应 |
| A. | 若W与Y的原子序数相差5,则二者形成化合物的化学式一定为Y2W3 | |
| B. | W与X形成的化合物中只含离子键 | |
| C. | W的气态氢化物的沸点一定高于Z的气态氢化物的沸点 | |
| D. | X、Y、Z、W的原子半径依次减小 |