题目内容
【题目】能源是人类生存和发展的重要支柱,化学在能源的开发与利用方面起着十分重要的作用。某学习小组按如下图所示装置探究化学能与电能的相互转化:
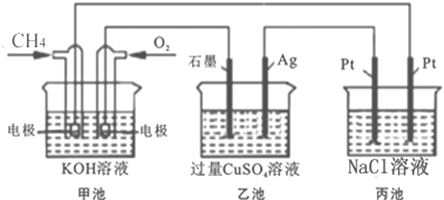
(1)甲池是_________装置,通入O2气体的电极上的反应式为______________。乙池中SO42-移向_____电极(填“石墨”或“Ag”)。
(2) 当甲池消耗标况下33.6L O2时,电解质KOH的物质的量变化_____mol,乙池若要恢复电解前的状态则需要加入__________(填所加物质的质量及化学式)。
(3) 丙池中发生的电解反应的离子方程式为______________。
【答案】原电池(或化学能转化为电能) O2 + 4e- +2H2O===4OH- 石墨 1.5 240gCuO(或372gCuCO3) 2Cl-+2H2O ![]() Cl2↑ + H2↑ + 2OH-
Cl2↑ + H2↑ + 2OH-
【解析】
(1)甲装置为燃料电池,O2在正极上得电子,碱性条件下生成氢氧根离子;乙池为电解池,阴离子移向阳极;
(2)甲装置为燃料,电池总反应为CH4+2O2+2OH-═CO32-+3H2O,据此计算电解质KOH的物质的量变化;乙中为电解硫酸铜溶液,根据电解的产物分析,根据“析出什么元素加入什么元素”的原则确定加入的物质;
(3)丙池为惰性电极电解氯化钠溶液生成氢气、氯气和氢氧化钠,据此书写电解反应的离子方程式。
(1)由图可看出甲图为燃料电池装置,是原电池(或化学能转化为电能);通入氧气的电极为正极,其电极反应式为:O2 + 4e- +2H2O===4OH-;乙图和丙图为电解池,与电池的正极相连的石墨为阳极,与电池的负极相连的Ag电极为阴极,则乙池中SO42- 移向石墨极(阳极),故答案为:原电池(或化学能转化为电能);O2 + 4e- +2H2O===4OH-;石墨;
(2)原电池正极反应式为:2O2+8e-+4H2O=8OH-,总反应为:CH4 +2O2+ 2OH-=CO32-+ 3H2O,当甲池消耗标况下33.6L(1.5mol)O2时,则消耗1.5mol KOH,转移6mol电子,则乙池生成3molCu和1.5molO2,根据原子守恒,若要恢复电解前的状态则需要加入氧化铜:3mol×80g/mol=240g,或碳酸铜:3mol×124g/mol=372g,故答案为:1.5;240gCuO(或372gCuCO3);
(3)丙池中惰性电极电解氯化钠溶液,电解反应的离子方程式为2Cl-+2H2O ![]() Cl2↑ + H2↑ + 2OH-。
Cl2↑ + H2↑ + 2OH-。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】下表为元素周期表的一部分,请参照元素①~⑩在表中的位置,用化学用语回答下列问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
1 | ① | |||||||
2 | ② | ③ | ④ | ⑤ | ||||
3 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(1)在这些元素中,化学性质最不活泼的元素的原子结构示意图为___,形成的单质是半导体的是___(填元素名称)。
(2)⑥与⑨形成的化合物的电子式为___,①与②形成的最简单化合物的结构式为___。
(3
(4)气态氢化物最稳定的是___(填化学式),②、③、⑧的原子半径最小是__(填素符号)。
(5)④与⑧形成的化合物的属于___(填“离子化合物”或“共价化合物”),该晶体属于___晶体(填“离子”、“分子”、“原子”)。
【题目】乙苯(![]() )、苯乙烯(
)、苯乙烯(![]() )均是重要的有机溶剂和工业原料。
)均是重要的有机溶剂和工业原料。
已知:①![]() (g)+HCl(g)
(g)+HCl(g)![]()
![]() (g) △H1= 54 kJmol1
(g) △H1= 54 kJmol1
②H2(g)+Cl2(g)=2HCl(g) △H2=185 kJmol1
③![]() (g)+Cl2(g)
(g)+Cl2(g)![]()
![]() (g)+HCl(g) △H3=118kJmol1
(g)+HCl(g) △H3=118kJmol1
④相关化学键的键能数据如表所示:
化学键 | CH | CC | C=C | CCl | HCl |
键能/(kJmol1) | 412 | 348 | x | 341 | 432 |
请回答:
(1)x=___;
(2)![]() (g)+H2(g)
(g)+H2(g)![]() (g) △H4
(g) △H4
①△H4=___。
②上述反应中,![]() 的平衡转化率α与温度(T)和压强(P)的关系如图所示。则:
的平衡转化率α与温度(T)和压强(P)的关系如图所示。则:
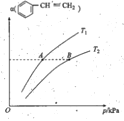
I.A、B两点的平衡常数:K(A)___K(B)(填“大于”、“小于”或“等于”)。
II.A、B两点的正反应速率:v(A)___v(B)(填“大于”、“小于”或“等于”)。
(3)工业中用乙苯(C6H5-CH2CH3)为原料,采用催化脱氢的方法制取苯乙烯(C6H5-CH=CH2)。向体积为VL的恒容容器中充入amol乙苯,压强为1×106Pa,在600℃时,平衡体系中苯乙烯的物质的量分数为25%,则:
①乙苯的平衡转化率为___;
②此温度下乙苯催化脱氢的方法制取苯乙烯的平衡常数Kp=___Pa;
③实际生产的反应在常压下进行,且向乙苯蒸气中掺入水蒸气,利用热力学数据计算得到温度和投料比对乙苯转化率的影响可用图表示。[M=n(H2O)/n(乙苯]
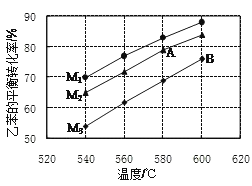
a.图中投料比(M1、M2、M3)的大小顺序为___;
b.随着反应的进行,催化剂上的少量积炭使其活性减弱,水蒸气有助于恢复催化剂的活性,原因是___(用化学方程式表示)。