题目内容
8.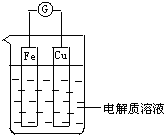 如图所示,组成一个原电池.
如图所示,组成一个原电池.(1)当电解质溶液为稀硫酸时:
①Fe电极是负(填“正”或“负”)极,其电极反应为Fe-2e-=Fe2+,该反应是氧化(填“氧化”或“还原”)反应;
②Cu电极是正(填“正”或“负”)极,其电极反应为2H++2e-=H2↑,该反应是还原(填“氧化”或“还原”)反应.
(2)当电解质溶液为浓硝酸时:Fe电极是正极,其电极反应为4H++2NO3-+2e-=2NO2↑+2H2O.
分析 (1)该装置中铁易失电子发生氧化反应,电极反应式为Fe-2e-=Fe2+,Cu作正极,正极上电极反应式为2H++2e-=H2↑,据此分析解答;
(2)Fe在浓硝酸中钝化,铁作为正极,电极反应式为:4H++2NO3-+2e-=2NO2↑+2H2O.
解答 解:(1)①Fe易失电子发生氧化反应而作负极,电极反应式为Fe-2e-=Fe2+,故答案为:负;Fe-2e-=Fe2+;氧化;
②Cu作正极,正极上氢离子得电子发生还原反应,电极反应式为2H++2e-=H2↑,故答案为:正;2H++2e-=H2↑;还原;
(2)Fe在浓硝酸中钝化,铁作为正极,电极反应式为:4H++2NO3-+2e-=2NO2↑+2H2O,故答案为:正;4H++2NO3-+2e-=2NO2↑+2H2O.
点评 本题考查原电池中电解质溶液对电极的影响,把握住问题的关键就是:负极发生氧化反应,正极发生还原反应即可.

练习册系列答案
相关题目
18.含有电子数均为3.01×1024的NH3和CH4,两者一定具有相同的( )
| A. | 质量 | B. | 体积 | C. | 物质的量 | D. | 氢原子数 |
19.化学与日常生活密切相关.下列说法不正确的是( )
| A. | 硅胶可作袋装食品的干燥剂 | B. | 84消毒液的有效成分是NaClO | ||
| C. | 浓硫酸可刻蚀石英制艺术品 | D. | 氢氧化铝可作胃酸的中和剂 |
16.化学与人类生活密切相关.下列说法正确的是( )
| A. | “钡餐”中使用的硫酸钡是弱电解质 | |
| B. | 镀锌铁镀层破损后,铁更容易被腐蚀 | |
| C. | 提倡人们购物时不用塑料袋,是为了防止白色污染 | |
| D. | 推广使用太阳能、风能、海洋能、氢能,不利于缓解温室效应 |
3.下列有关难溶电解质溶解沉淀平衡的说法不正确的是( )
| A. | 由于Ksp(Ag2S)<Ksp(AgI),向含浓度分别为0.01mol/L的S2-与I-的混合溶液中加入足量的AgNO3(s),只有Ag2S沉淀生成 | |
| B. | FeS在水中的溶解度大于在Na2S溶液中的 | |
| C. | 向含有AgCl(s)的饱和AgCl溶液中加水,固体AgCl质量会减少,但AgCl的溶解度与Ksp均不变 | |
| D. | 达到沉淀溶解平衡时,溶液中离子浓度不一定相等但会保持不变 |
13.核电站遭破坏,会造成放射性物质${\;}_{53}^{131}$I和${\;}_{55}^{137}$Cs向外界泄漏.下列有关说法错误的是( )
| A. | 每个${\;}_{55}^{137}$Cs含有82个中子 | B. | CsOH的碱性比KOH的强 | ||
| C. | HI的还原性比HF的强 | D. | KIO3是碘的最高价含氧酸的盐 |
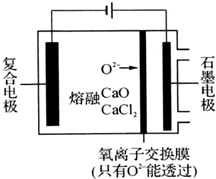 纳米二氧化钛作为一种新型的光催化剂,其用途相当广泛.金属钛具有优良的性能,是航天工业的重要材料.水解法制备纳米二氧化钛和电解钛的过程如下:
纳米二氧化钛作为一种新型的光催化剂,其用途相当广泛.金属钛具有优良的性能,是航天工业的重要材料.水解法制备纳米二氧化钛和电解钛的过程如下:
 .
.