题目内容
13.核电站遭破坏,会造成放射性物质${\;}_{53}^{131}$I和${\;}_{55}^{137}$Cs向外界泄漏.下列有关说法错误的是( )| A. | 每个${\;}_{55}^{137}$Cs含有82个中子 | B. | CsOH的碱性比KOH的强 | ||
| C. | HI的还原性比HF的强 | D. | KIO3是碘的最高价含氧酸的盐 |
分析 A.中子数=质量数-质子数,据此计算判断;
B.元素的金属性越强,对应最高价氧化物的水化物的碱性越强;
C.元素的非金属性越强,对应氢化物的还原性越弱;
D.主族元素的最高正价等于其族序数(O、F除外).
解答 解:A.中子数=质量数-质子数,则每个13755Cs含有的中子为137-55=82,故A正确;
B.元素的金属性越强,对应最高价氧化物的水化物的碱性越强,金属性:Cs>K,则CsOH的碱性比KOH的强,故B正确;
C.元素的非金属性越强,对应氢化物的还原性越弱,非金属性:F>I,则还原性:HI>HF,故C正确;
D.主族元素的最高正价等于其族序数(O、F除外),I属于第VIIA族元素,其最高正价为+7价,则KIO3不是碘的最高价含氧酸的盐,故D错误.
故选D.
点评 本题考查了原子的构成、元素周期律、最高化合价与族序数的关系等,题目难度不大,注意把握同周期、同主族元素性质的变化规律.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
4.工业上常用氨碱法制取碳酸钠(将氨和二氧化碳分别先后通入饱和食盐水而析出小苏打,再经过滤、焙烧,得纯碱),却不能用氨碱法制碳酸钾,这是因为在溶液中( )
| A. | KHCO3溶解度较大 | B. | KHCO3溶解度较小 | C. | K2CO3溶解度较大 | D. | K2CO3溶解度较小 |
1.有机物大多易挥发,因此许多有机物保存时为避免挥发损失,可加一层水即“水封”,下列有机物可以用“水封法”保存的是( )
| A. | 己烷 | B. | CHCl3 | C. | 苯酚 | D. | 酒精 |
18.一定温度下,1mol X和n mol Y在容积为2L的密闭容器中发生如下反应:X(g)+Y(g)?2Z(g)+M(s),5min后达到平衡,此时生成2a mol Z.下列说法正确的是( )
| A. | 当混合气体的质量不再发生变化时,说明反应达到平衡状态 | |
| B. | 用M表示此反应速率是0.1 a mol•(L•min)-1 | |
| C. | 用X表示此反应的反应速率是(0.1-0.2 a)mol•(L•min)-1 | |
| D. | 其他条件不变向上述平衡体系中再充入lmolX,v(正)增大,v(逆)减小,平衡正向移动 |
5.过氧化氢H2O2,(氧的化合价为-1价),俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口.根据四个H2O2参与的化学方程式判断下列说法正确的是( )
①Na2O2+2HCl=2NaCl+H2O2
②Ag2O+H2O2=2Ag+O2↑+H2O
③2H2O2=2H2O+O2↑
④3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O.
①Na2O2+2HCl=2NaCl+H2O2
②Ag2O+H2O2=2Ag+O2↑+H2O
③2H2O2=2H2O+O2↑
④3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O.
| A. | 上述反应说明H2O2、Ag2O、K2CrO4氧化性由强到弱的顺序是Ag2O>H2O2>K2CrO4 | |
| B. | H2O2既体现氧化性又体现还原性的反应是①③ | |
| C. | H2O2仅体现氧化性的反应是② | |
| D. | H2O2仅体现还原性的反应是③ |
2.下列关于蒸发皿的使用操作正确的是( )
| A. | 用酒精灯火焰的外焰部分直接加热蒸发皿底部 | |
| B. | 蒸发液体时,边加热边用玻璃棒不断搅动蒸发皿里的液体直到把液体完全蒸干 | |
| C. | 将热的蒸发皿用手拿离火焰,放在实验台上 | |
| D. | 将灼热的蒸发皿直接放在冰水中冲洗 |
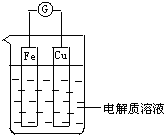 如图所示,组成一个原电池.
如图所示,组成一个原电池. 某温度下,在2L容器中X、Y、Z三种气体的物质的量(n)随着时间的(t)变化的曲线如图所示.由图中数据分写:
某温度下,在2L容器中X、Y、Z三种气体的物质的量(n)随着时间的(t)变化的曲线如图所示.由图中数据分写: