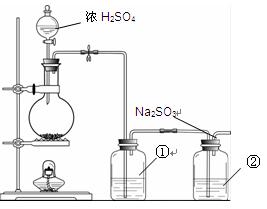
题目内容
I.课本中介绍了乙醇氧化的实验:把一端弯成螺旋状的铜丝放在酒精灯外焰加热,待铜丝表面变黑后立即把它插入盛有约2 mL乙醇的试管里,反复操作几次。注意闻生成物的气味,并观察铜丝表面的变化。
(1)实验室可用化学方法替代“闻生成物的气味”,写出该化学方法的化学反应方程式__________________________________________________。
(2)某同学在探究“闻生成物的气味”的替代方法时,偶然发现向溴水中加入乙醛溶液,溴水褪色。该同学为解释上述现象,提出两种猜想:①溴水将乙醛氧化为乙酸;②溴水与乙醛发生加成反应。请你设计一个简单的实验,探究哪一种猜想正确?
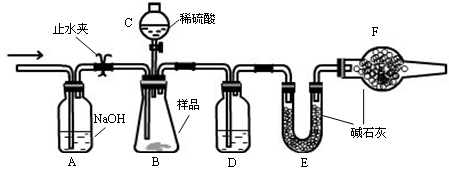
Ⅱ.某课外活动小组利用下图装置进行乙醇的催化氧化实验并制取乙醛(试管丙中用水吸收产物),图中铁架台等装置已略去。实验时,先加热玻璃管中的铜丝,约lmin后鼓入空气。请填写下列空白:
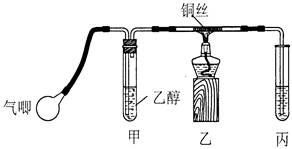
(1)乙醇发生催化氧化的化学反应方程式为________________________________________。
(2)实验时,常常将甲装置浸在70℃~80℃的水浴中,目的是____________________;由于装置设计上的缺陷,实验进行时可能会______________________________。
(3)反应发生后,移去酒精灯,利用反应自身放出的热量可维持反应继续进行。进一步研究表明,鼓气速度与反应体系的温度关系曲线如图所示。
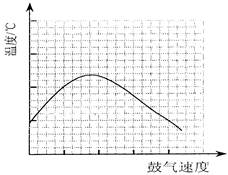
试解释出现图中现象的原因:______________________________;你认为该实验中“鼓气速度”这一变量可用______________________________来计量。
(1)实验室可用化学方法替代“闻生成物的气味”,写出该化学方法的化学反应方程式__________________________________________________。
(2)某同学在探究“闻生成物的气味”的替代方法时,偶然发现向溴水中加入乙醛溶液,溴水褪色。该同学为解释上述现象,提出两种猜想:①溴水将乙醛氧化为乙酸;②溴水与乙醛发生加成反应。请你设计一个简单的实验,探究哪一种猜想正确?
Ⅱ.某课外活动小组利用下图装置进行乙醇的催化氧化实验并制取乙醛(试管丙中用水吸收产物),图中铁架台等装置已略去。实验时,先加热玻璃管中的铜丝,约lmin后鼓入空气。请填写下列空白:

(1)乙醇发生催化氧化的化学反应方程式为________________________________________。
(2)实验时,常常将甲装置浸在70℃~80℃的水浴中,目的是____________________;由于装置设计上的缺陷,实验进行时可能会______________________________。
(3)反应发生后,移去酒精灯,利用反应自身放出的热量可维持反应继续进行。进一步研究表明,鼓气速度与反应体系的温度关系曲线如图所示。

试解释出现图中现象的原因:______________________________;你认为该实验中“鼓气速度”这一变量可用______________________________来计量。
I.(1)CH3CHO+2Ag(NH3)2OH  CH3COONH4+2Ag↓+H2O+3NH3
CH3COONH4+2Ag↓+H2O+3NH3
(2)检测溴水与褪色后溶液的酸、碱性,若酸性明显增强,则猜想①正确,反之猜想②正确。
II.(1)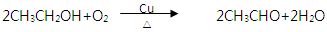
(2)得到平稳的C2H5OH蒸汽 倒吸
(3)开始随鼓气速度增加,反应的量增多放热多,后来,由于鼓气速度太快,末反应的气体将热量带走,温度下降;单位时间内甲中的气泡数
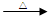 CH3COONH4+2Ag↓+H2O+3NH3
CH3COONH4+2Ag↓+H2O+3NH3(2)检测溴水与褪色后溶液的酸、碱性,若酸性明显增强,则猜想①正确,反之猜想②正确。
II.(1)
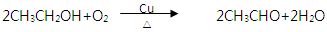
(2)得到平稳的C2H5OH蒸汽 倒吸
(3)开始随鼓气速度增加,反应的量增多放热多,后来,由于鼓气速度太快,末反应的气体将热量带走,温度下降;单位时间内甲中的气泡数
乙醇催化氧化为: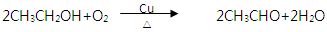
I.(1)产物乙醛中含有醛基,可通过银镜反应来检验它的存在:CH3CHO+2Ag(NH3)2OH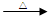 CH3COONH4+2Ag↓+H2O+3NH3(当然也可通过与新制的氢氧化铜溶液反应有砖红色沉淀生成来检验)
CH3COONH4+2Ag↓+H2O+3NH3(当然也可通过与新制的氢氧化铜溶液反应有砖红色沉淀生成来检验)
(2)溴水将乙醛氧化为乙酸导致溶液酸性增强,故可通过检验溴水与褪色后溶液的酸、碱性即可判定
II.(1)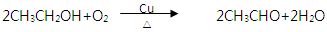
(2)乙醇在70℃~80℃的水浴中加热,可得到平稳的C2H5OH蒸汽
由于乙醇及乙醛均易溶于试管C的水中,故易引起倒吸
(3)乙醇的催化氧化反应为放热反应;
由图可看出,,在一定范围内,鼓气速度越大,反应体系的温度升高,说明反应物的量增多放热多;但鼓气速度太快,末反应的气体将热量带走,反应体系的温度反而降低。
可通过观察单位时间内甲中的气泡数来间接估计鼓气速度
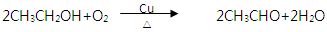
I.(1)产物乙醛中含有醛基,可通过银镜反应来检验它的存在:CH3CHO+2Ag(NH3)2OH
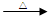 CH3COONH4+2Ag↓+H2O+3NH3(当然也可通过与新制的氢氧化铜溶液反应有砖红色沉淀生成来检验)
CH3COONH4+2Ag↓+H2O+3NH3(当然也可通过与新制的氢氧化铜溶液反应有砖红色沉淀生成来检验)(2)溴水将乙醛氧化为乙酸导致溶液酸性增强,故可通过检验溴水与褪色后溶液的酸、碱性即可判定
II.(1)
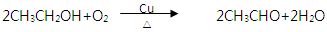
(2)乙醇在70℃~80℃的水浴中加热,可得到平稳的C2H5OH蒸汽
由于乙醇及乙醛均易溶于试管C的水中,故易引起倒吸
(3)乙醇的催化氧化反应为放热反应;
由图可看出,,在一定范围内,鼓气速度越大,反应体系的温度升高,说明反应物的量增多放热多;但鼓气速度太快,末反应的气体将热量带走,反应体系的温度反而降低。
可通过观察单位时间内甲中的气泡数来间接估计鼓气速度

练习册系列答案
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案
相关题目
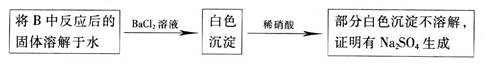
 CO2↑+CO↑+H2O
CO2↑+CO↑+H2O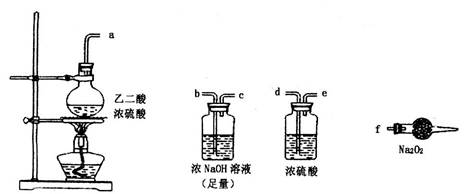

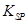 = 2.70×10-39]
= 2.70×10-39]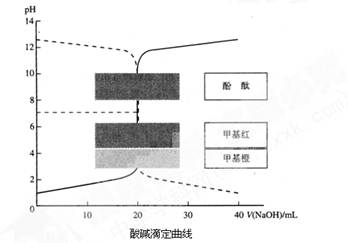
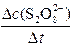 。
。