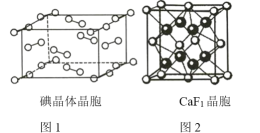
题目内容
【题目】钴的化合物在工业生产、生命科技等行业有重要应用。
(1)Co2+的核外电子排布式为_______,Co的第四电离能比 Fe 的第四电离能要小得多,原因是__________________________。
(2)Co2+ 、Co3+都能与 CN一形成配位数为6的配离子。CN一中碳原子的杂化方式为____________;HCN分子中含有![]() 键的数目为__________________。
键的数目为__________________。
(3)用KCN处理含Co2+的盐溶液 ,有红色的Co(CN)2 析出,将它溶于过量的KCN溶液后,可生成紫色的[Co(CN)6] 4- ,该配离子是一种相当强的还原剂,在加热时能与水反应生成[Co(CN )6]3-,写出该反应的离子方程式:_______________。
(4)金属钴的堆积方式为六方最密堆积,其配位数是 _____。有学者从钴晶体中取出非常规的“六棱柱”晶胞,结构如图所示,该晶胞中原子个数为_____,该晶胞的边长为a nm,高为c nm,该晶体的密度为___gcm-3(NA表示阿伏加德罗常数的值,列出代数式)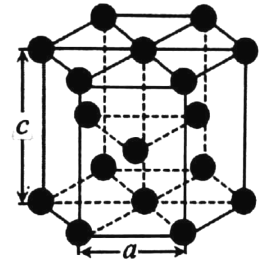
【答案】![]() 钴原子失去4个电子后可以得到
钴原子失去4个电子后可以得到![]() 的稳定结构,因此更容易失去第4个电子,表现为第四电离能较小 sp 2
的稳定结构,因此更容易失去第4个电子,表现为第四电离能较小 sp 2 ![]() 12 6
12 6 
【解析】
(1)钴是27号元素,其电子排布为![]() ,再来分析即可;
,再来分析即可;
(2)碳原子最外层有4个电子,需要成4个键才能达到稳定结构,氮原子最外层有5个电子,需要成3个键才能达到稳定结构,而氢原子只能成1个键,据此不难推出![]() 的结构为
的结构为![]() ,再来分析其碳原子的杂化方式和
,再来分析其碳原子的杂化方式和![]() 键的数目即可;
键的数目即可;
(3)注意一个![]() 带-1价,因此该反应的实质相当于钴从+2价被氧化为+3价,水中自然只有氢能被还原,从+1价被还原为0价的单质;
带-1价,因此该反应的实质相当于钴从+2价被氧化为+3价,水中自然只有氢能被还原,从+1价被还原为0价的单质;
(4)根据观察,每个钴原子的配位数为12,即周围一圈6个,上、下各3个,而晶体密度只需按照![]() 来构造公式即可。
来构造公式即可。
(1)钴的电子排布式为![]() ,钴原子失去4个电子后可以得到
,钴原子失去4个电子后可以得到![]() 的稳定结构,因此更容易失去第4个电子,表现为第四电离能较小;
的稳定结构,因此更容易失去第4个电子,表现为第四电离能较小;
(2)![]() 为直线型分子,因此其碳原子的杂化方式为
为直线型分子,因此其碳原子的杂化方式为![]() 杂化,而1个
杂化,而1个![]() 分子中有2个
分子中有2个![]() 键和2个
键和2个![]() 键;
键;
(3)根据分析,反应方程式为![]() ;
;
(4)根据分析,钴原子的配位数为12,在计算一个晶胞中的原子数时,12个顶点上的原子按![]() 算,上下表面面心的原子按
算,上下表面面心的原子按![]() 算,体内的按1个算,因此一个晶胞内一共有
算,体内的按1个算,因此一个晶胞内一共有![]() 个原子;而晶体密度为
个原子;而晶体密度为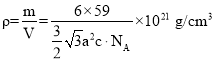 。
。

【题目】根据下列实验操作和现象所得到的结论正确的是( )
选项 | 实验操作和现象 | 结 论 |
A | 含有酚酞的Na2CO3溶液中加入少量BaCl2固体,溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
B | 用铂丝蘸取少量NaCl溶液进行焰色反应,火焰呈黄色 | 这是钠离子的发射光谱 |
C | NaI溶液 | 酸性条件下H2O2的氧化性比I2强 |
D | 向浓度均为0.1 mol·L-1的NaCl和NaI混合溶液中滴加少量AgNO3溶液,先出现黄色沉淀 | Ksp(AgCl)<Ksp(AgI) |
A.AB.BC.CD.D