题目内容
【题目】常温下,浓度均为0.1 mol/L体积均为V0的HA、HB溶液分别加水稀释至体积为 V的溶液。稀释过程中,pH与![]() 的变化关系如图所示。下列叙述正确的是
的变化关系如图所示。下列叙述正确的是
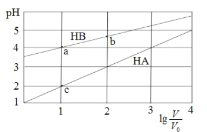
A.pH 随 ![]() 的变化始终满足直线关系
的变化始终满足直线关系
B.溶液中水的电离程度:a > b > c
C.该温度下,Ka(HB)≈ 10-6
D.分别向稀释前的HA、HB溶液中滴加 NaOH 溶液至 pH = 7 时,c(A-)= c(B-)
【答案】C
【解析】
从图中可以看出,0.1mol/LHA的pH=1,HA为强酸;0.1mol/LHA的pH在3~4之间,HB为弱酸。
A.起初pH 随 ![]() 的变化满足直线关系,当pH接近7时出现拐点,且直线与横轴基本平行,A不正确;
的变化满足直线关系,当pH接近7时出现拐点,且直线与横轴基本平行,A不正确;
B.溶液的酸性越强,对水电离的抑制作用越大,水的电离程度越小,由图中可以看出,溶液中c(H+):c >a > b,所以水的电离程度:b >a> c,B不正确;
C.在a点,c(H+)=c(B-)≈10-4mol/L,c(HB)=0.01mol/L,该温度下,Ka(HB)=![]() ≈ 10-6,C正确;
≈ 10-6,C正确;
D.分别向稀释前的HA、HB溶液中滴加 NaOH 溶液至 pH = 7 时,HB中加入NaOH的体积小,所以c(A-)>c(B-),D不正确;
故选C。

【题目】硝酸氯(ClNO)是有机合成中的重要试剂。亚硝酸氯可由NO与Cl2在通常条件下反应得到,化学方程式为2NO(g)+Cl2(g) ![]() 2ClNO(g)。
2ClNO(g)。
(1)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酸氯,涉及如下反应:
①4NO2(g)+2NaCl(s) ![]() 2NaNO3(s)+2NO(g)+Cl2(g) K1
2NaNO3(s)+2NO(g)+Cl2(g) K1
②2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g) K2
NaNO3(s)+ClNO(g) K2
③2NO(g)+Cl2(g)![]() 2ClNO(g) K3
2ClNO(g) K3
则K1,K2,K3之间的关系为K3=______________。
(2)T℃时,2NO(g)+Cl2(g) ![]() 2ClNO(g)的正反应速率表达式为v正= k cn(ClNO),测得速率和浓度的关系如下表:
2ClNO(g)的正反应速率表达式为v正= k cn(ClNO),测得速率和浓度的关系如下表:
序号 | c(ClNO)/mol·L-1 | v/mol·L-1·s-1 |
① | 0.30 | 3.6×10-8 |
② | 0.60 | 1.44×10-7 |
③ | 0.90 | 3.24×10-7 |
n=____________;k=____________(注明单位)。
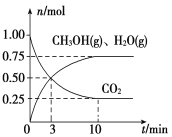
(3)在2L的恒容密闭容器中充入4mol NO(g)和2mol Cl2(g),在不同温度下测得c(ClNO)与时间的关系如图A
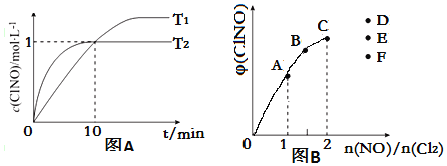
①温度为T1时,能作为该反应达到平衡的标志的有__________;
a 容器体积保持不变
b 容器压强保持不变
c 平衡常数K保持不变
d 气体颜色保持不变
e v(ClNO)= v(NO)
f NO与ClNO的物质的量比值保持不变
②反应开始到10min时Cl2的平均反应速率v(Cl2)=____________;
③温度为T2时,10min已经达到平衡,该反应的平衡常数K
(4)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数φ随n(NO)/n(Cl2)的变化图象如图B,则A、B、C三状态中,NO的转化率最小的是__________点,当n(NO)/n(Cl2)=2.8时,达到平衡状态ClNO的体积分数φ可能是D、E、F三点中的__________点。