题目内容
13.按图实验装置进行实验,回答下列问题:
(1)用于与Na2SO3作用的硫酸要使用浓硫酸(填“稀硫酸”或“浓硫酸”)
(2)烧杯中NaOH溶液在实验中的作用是吸收尾气二氧化硫,防止二氧化硫污染环境;发生反应的化学方程式2NaOH+SO2=Na2SO3+H2O.
(3)直形试管中各处观察到的现象分别是:A品红褪色;B高锰酸钾褪色;C生成淡黄色固体;D溶液为红色.
分析 由图可知,在烧瓶中发生H2SO4+Na2SO3=Na2SO4+SO2↑+H2O,发生强酸制取弱酸的反应,为防止二氧化硫的溶解需要浓硫酸,A处二氧化硫使品红褪色,B处二氧化硫与高锰酸钾发生氧化还原反应,C处二氧化硫与氢硫酸发生氧化还原反应生成S,D处二氧化硫与水反应生成亚硫酸,最后NaOH吸收尾气,以此来解答.
解答 解:由图可知,在烧瓶中发生H2SO4+Na2SO3=Na2SO4+SO2↑+H2O,发生强酸制取弱酸的反应,为防止二氧化硫的溶解需要浓硫酸,A处二氧化硫使品红褪色,B处二氧化硫与高锰酸钾发生氧化还原反应,C处二氧化硫与氢硫酸发生氧化还原反应生成S,D处二氧化硫与水反应生成亚硫酸,最后NaOH吸收尾气,
(1)用于与Na2SO3作用的硫酸要使用浓硫酸,故答案为:浓硫酸;
(2)烧杯中NaOH溶液在实验中的作用是吸收尾气二氧化硫,防止二氧化硫污染环境;发生反应的化学方程式为2NaOH+SO2=Na2SO3+H2O,
故答案为:吸收尾气二氧化硫,防止二氧化硫污染环境;2NaOH+SO2=Na2SO3+H2O;
(3)由发生的反应可知,直形试管中A、B、C、D各处观察到的现象分别是品红褪色、高锰酸钾褪色、生成淡黄色固体、溶液为红色,
故答案为:品红褪色;高锰酸钾褪色;生成淡黄色固体;溶液为红色.
点评 本题考查物质的制备及性质实验,为高频考点,把握发生的反应、实验装置的作用及实验技能为解答的关键,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目
3.今有A、B两种原子,A原子的M层比B原子的M层少2个电子,B原子的L层电子数为A原子L层电子数的2倍.A和B分别是( )
| A. | C和Mg | B. | Si和Na | C. | Cl和C | D. | B和He |
1.化合物HIn在水溶液中因存在以下电离平衡:HIn(aq,红色)?H++In-(aq,黄色),故可用作酸碱指示剂.浓度为0.02mol/L的下列各溶液:(1)HCl (2)石灰水 (3)NaCl(aq) (4)NaHCO3(aq),其中能使指示剂显红色的是( )
| A. | (1) | B. | (2) | C. | (3) | D. | (4) |
8.X元素的阳离子和Y元素的阴离子具有相同的电子层结构,下列叙述正确的是( )
| A. | 原子序数:X<Y | B. | 电负性:X<Y | C. | 离子半径:X>Y | D. | 原子半径:X<Y |
18.下列气体无色无味的是( )
| A. | 氯气 | B. | 二氧化硫 | C. | 氨气 | D. | 氮气 |
 .
. .
.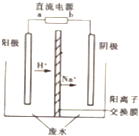 用甲烷、甲醇、乙醇、甲醚等可以制成燃料电池.实验室中,若以甲醇燃料电池为直流电源,以一定浓度的乙醛和 Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其原理是乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸,其装置示意图如图所示.
用甲烷、甲醇、乙醇、甲醚等可以制成燃料电池.实验室中,若以甲醇燃料电池为直流电源,以一定浓度的乙醛和 Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其原理是乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸,其装置示意图如图所示. .
.