题目内容
【题目】CO是大气污染气体,可利用化学反应进行治理或转化。
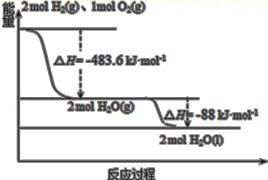
(1)甲醇是重要的溶剂和燃料,工业上用CO和H2在一定条件下制备CH3OH的反应为:CO(g)+2H2(g)![]() CH3OH(g) ΔH<0
CH3OH(g) ΔH<0
①T℃时,向容积为2 L的恒容密闭容器中充入1 mol CO和1.2 mol H2,一段时间后达到平衡,此时H2与CH3OH的体积分数之比为2∶5,该反应的平衡常数K=____;此时若向容器中再通入0.4 mol CO和0.2 mol CH3OH(g),则平衡将____移动。(填“向正反应方向”、“不”或“向逆反应方向”)
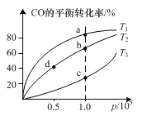
②在一容积可变的密闭容器中充入一定物质的量的CO和H2,测得CO在不同温度下的平衡转化率与压强的关系如图所示。a、b、c三点平衡常数K(a)、K(b)、K(c)的大小关系是____。b、d两点的正反应速率vb(CO)____vd(CO)。
(2)沥青混凝土可作为2CO(g)+O2(g)![]() 2CO2(g)反应的催化剂。如图表示在相同的恒容密闭容器、相同起始浓度、反应相同的时间,使用同质量的不同沥青混凝土(α型、β型)催化时,CO的转化率与温度的关系。
2CO2(g)反应的催化剂。如图表示在相同的恒容密闭容器、相同起始浓度、反应相同的时间,使用同质量的不同沥青混凝土(α型、β型)催化时,CO的转化率与温度的关系。
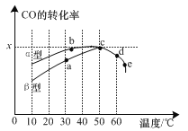
①a、b、c、d四点中表示平衡状态的是____;
②相同条件下,____型沥青混凝土催化效果更佳;
③e点转化率出现突变的原因可能是____。
【答案】100 向正反应方向 K(a)>K(b)>K(c) > c、d α型 温度升高后催化剂失去活性
【解析】
(1)①T℃时, CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
起始浓度(mol/L) 0.5 0.6 0
起始浓度(mol/L) c 2c c
起始浓度(mol/L) 0.5-c 0.6-2c c
平衡时H2与CH3OH的体积分数之比为2∶5,即:(0.6-2c):c =2∶5,解得:c=0.25;结合平衡常数K=![]() 计算;此时若向容器中再通入0.4 mol CO和0.2 mol CH3OH(g),根据Qc=
计算;此时若向容器中再通入0.4 mol CO和0.2 mol CH3OH(g),根据Qc=![]() 判断;
判断;
②由于该反应的正反应为放热反应,在其他条件不变的情况下,升高温度,平衡向吸热的方向移动,即向逆反应方向移动,反应物转化率降低,由于a>b>c,则温度:T1<T2<T3,再结合平衡常数与温度的影响因素分析;在恒温条件下,增大压强,反应速率加快;
(2)相同温度下α型沥青混凝土中CO降解速率比β型要大;e点降解率出现突变的原因可结合催化剂的催化效率分析。
(1)①T℃时, CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
起始浓度(mol/L) 0.5 0.6 0
起始浓度(mol/L) c 2c c
起始浓度(mol/L) 0.5-c 0.6-2c c
平衡时H2与CH3OH的体积分数之比为2∶5,即:(0.6-2c):c =2∶5,解得:c=0.25,平衡常数K=![]() =
=![]() =100;此时若向容器中再通入0.4 mol CO和0.2 mol CH3OH(g),根据Qc=
=100;此时若向容器中再通入0.4 mol CO和0.2 mol CH3OH(g),根据Qc=![]() =
= =77.7<100,说明此时平衡正向移动;
=77.7<100,说明此时平衡正向移动;
②由图示知温度T1<T2<T3,且温度升高平衡逆向移动,则a、b、c三点平衡常数K(a)、K(b)、K(c)的大小关系是K(a)>K(b)>K(c),在其他条件相同时,增大压强,化学反应速率加快,由于压强b>d,速率vb(CO)>vd(CO);
(2)①当反应达到平衡状态后,升高温度平衡要逆向移动,CO的转化率会降低,则a、b、c、d 四点中表示平衡状态的是c、d;
②由图得,相同条件下α型沥青混凝土中CO降解速率比β型要大,α型沥青混凝土催化效果更佳;
③e点降解率出现突变的原因可能是温度升高后催化剂失去活性失效。

【题目】电解质溶液中存在多种平衡。请回答下列问题:
(1)已知:
化学式 | CH3COOH | HClO |
电离常数(25℃) | 1.8×10-5 | 3.0×10-8 |
物质的量浓度均为0.1mol/L的下列溶液:a. CH3COOH b. HClO ,比较二者C(H+)的大小:a______b(填“>”、“<”或“=”)。
(2)常温下,将 0.1mol/L 的 CH3COOH 溶液加水稀释,在稀释过程中,下列表达式的数值变大的 __________(填字母)。
A. c(H+) B.  C. c(H+)·c(OH-)
C. c(H+)·c(OH-)
(3)25℃时,体积均为 10mL,pH 均为 2 的醋酸溶液与一元酸 HX 溶液分别加水稀释至 1000mL,稀释过程中 pH 的变化如图所示。已知:pH= -lgC(H+),则:

①25℃时,醋酸的电离常数________HX的电离常数。(填“>”、“<”或“=”)
②稀释100倍后, 醋酸溶液中由水电离出的 c(H+)________ HX溶液中由水电离出的c(H+)。(填“>”、“<”或“=”)