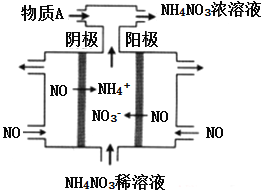
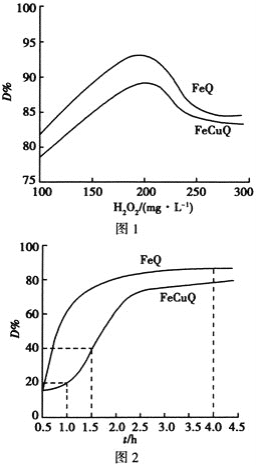
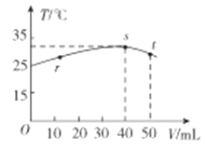
题目内容
【题目】有 A、B、C、D 四种元素,它们的原子序数依次增大,由 B、C、D 形成的离子具有相同的电子层结构。C、D 单质都能跟水剧烈反应,1mol C 单质跟水反应产生 11.2L(标准状况下)B 气体单质,1mol D 单质跟水反应产生 11.2L(标准状况下)A 气体单质,此时 D 转化成具有氖原子核外电子层结构的离子。试填空:
(1)B 元素的名称为_____;D 在元素周期表中位置为_____。
(2)C 原子的结构示意图为_____,A 与 D 形成化合物的电子式为_____。
(3)写出 C、D 单质分别与水反应的化学方程式:C+H2O:_____; D+H2O:_____。
(4)B 与 D 形成的两种化合物中,其中一种物质含有两种类型的化学键,分别为_____,该物质属于_____(填“离子化合物”或“共价化合物”)。
【答案】氧 第三周期第ⅠA族 ![]() Na+[:H]- 2F2+2H2O=4HF+O2 2Na+2H2O=2NaOH+H2↑ 离子键、共价键(或离子键、非极性键) 离子化合物
Na+[:H]- 2F2+2H2O=4HF+O2 2Na+2H2O=2NaOH+H2↑ 离子键、共价键(或离子键、非极性键) 离子化合物
【解析】
由“C、D 单质都能跟水剧烈反应,1mol C 单质跟水反应产生 11.2L(标准状况下)B 气体单质,1mol D 单质跟水反应产生 11.2L(标准状况下)A 气体单质”,可推出C为F,D为Na,A为H。再由“由 B、C、D 形成的离子具有相同的电子层结构”,可推出B为O。
(1)由以上推断可知,B 和D 分别 为O、Na,由此可知B的名称及D在周期表中的位置。
(2)C 为氟,A 与 D 形成化合物为NaH。
(3) C与水反应,生成HF和O2,D 单质与水反应,生成NaOH和H2。
(4)B 与 D 形成的两种化合物中,其中一种物质含有两种类型的化学键,则其为Na2O2。
(1)B 元素的名称为氧;D 为钠,其在元素周期表中位置为第三周期第ⅠA族。答案为:氧;第三周期第ⅠA族;
(2)C 为氟,其原子的结构示意图为![]() ,A 与 D 形成化合物为NaH,电子式为Na+[:H]-。答案为:
,A 与 D 形成化合物为NaH,电子式为Na+[:H]-。答案为:![]() ;Na+[:H]-;
;Na+[:H]-;
(3) C、D 单质分别与水反应的化学方程式:C+H2O:2F2+2H2O=4HF+O2; D+H2O:2Na+2H2O=2NaOH+H2↑。答案为:2F2+2H2O=4HF+O2;2Na+2H2O=2NaOH+H2↑;
(4)B 与 D 形成的两种化合物中,Na2O2中含有两种类型的化学键,分别为Na+与O22-间的离子键、O22-内两个O原子间的共价键(或离子键、非极性键),该物质含有离子键,属于离子化合物。答案为:离子键、共价键(或离子键、非极性键);离子化合物。

 名校课堂系列答案
名校课堂系列答案【题目】在密闭容器中,投入1 mol N2和3 mol H2分别在以下不同实验条件下进行反应。下列分析正确的是
容器编号 | 实验条件 | 平衡时反应中的能量变化 |
I | 恒温恒容 | 放热Q1kJ |
II | 恒温恒压 | 放热Q2kJ |
A.放出热量:Q1<Q2B.N2的转化率:II>I
C.平衡常数:II>ID.平衡时氨气的体积分数:I>II