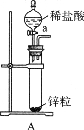
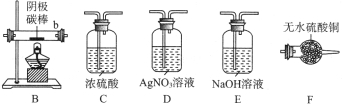
题目内容
20.下列实验、现象及相关结论均正确的是( )| A | B | C | D | |
| 实验 | 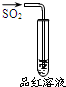 | 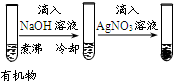 |  | 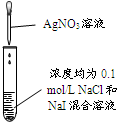 |
| 现象 | 品红褪色 | 最后试管有浅黄色沉淀 | 最后一滴溶液使酚酞由无色变为粉红色,且30秒不复原 | 出现白色沉淀 |
| 结论 | SO2有强氧化性 | 有机物中含有溴原子 | 滴定达到终点 | Ksp(AgCl)>Ksp(AgI) |
| A. | A | B. | B | C. | C | D. | D |
分析 A.SO2具有漂白性;
B.应加入氢氧化钠水解后再加硝酸酸化;
C.用氢氧化钠滴定盐酸,可用酚酞为指示剂,滴定终点为最后一滴标液使酚酞由无色变为红色,且30秒不复原;
D.应先出现黄色沉淀.
解答 解:A.SO2具有漂白性,可使品红褪色,其中硫元素化合价为+4价,具有较强的还原性,故A错误;
B.应加入氢氧化钠水解后再加硝酸酸化,否则不能得到浅黄色沉淀,故B错误;
C.用氢氧化钠滴定盐酸,可用酚酞为指示剂,滴定终点为最后一滴标液使酚酞由无色变为红色,且30秒不复原,故C正确;
D.AgI溶解度较小,应先出现黄色沉淀,故D错误.
故选C.
点评 本题考查较为综合,涉及二氧化硫的性质、卤代烃的水解、中和滴定以及难溶电解质的溶解平衡等知识,侧重于学生的分析能力和实验能力的考查,注意相关物质的性质,把握实验方案的严密性和合理性的评价,难度中等.

练习册系列答案
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案
相关题目
10.短周期元素X、Y、Z、W、M的原子序数依次增大,X、Z同主族,Z、W、M同周期,其中X和Y能形成两种物质,且常温下均为液体.W的氧化物既能溶于强碱溶液,又能溶于X、M形成的水溶液.已知W与M形成的物质在178℃时升华.下列说法不正确的是( )
| A. | Z、W、M的原子半径由大到小的顺序为Z>W>M | |
| B. | M分别与Z、W所形成的物质的晶体类型相同 | |
| C. | X2Y2易溶于X2Y中,是由于X2Y2与X2Y能形成分子间氢键 | |
| D. | 将Z2Y在空气中加热可得到Z2Y2 |
11.下列说法正确的是( )
| A. | 戊烷、戊醇、戊烯、乙酸乙酯中同分异构体数目最少的是戊烯 | |
| B. | 分子式为C5H12O且可与金属钠反应放出氢气的有机化合物有8种 | |
| C. | 将2-丙醇与NaOH的醇溶液共热可制备CH3-CH=CH2 | |
| D. |  三种氨基酸脱水,最多可生成6种二肽 三种氨基酸脱水,最多可生成6种二肽 |
8.下列有关钢铁腐蚀和防护的说法不正确的是( )
| A. | 自行车的钢圈上镀一层铬,防止生锈 | |
| B. | 外加直流电源保护钢闸门时,钢闸门与电源的负极相连 | |
| C. | 钢铁发生吸氧腐蚀的正极反应:2H2O+O2+4e-═4OH- | |
| D. | 钢铁发生析氢腐蚀的负极反应:Fe-3e-═Fe3+ |
15. 常温下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1mol•L-1的NaOH溶液.整个实验进程中溶液的pH变化曲线如图所示,下列叙述正确的是( )
常温下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1mol•L-1的NaOH溶液.整个实验进程中溶液的pH变化曲线如图所示,下列叙述正确的是( )
 常温下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1mol•L-1的NaOH溶液.整个实验进程中溶液的pH变化曲线如图所示,下列叙述正确的是( )
常温下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1mol•L-1的NaOH溶液.整个实验进程中溶液的pH变化曲线如图所示,下列叙述正确的是( )| A. | 实验进程中可用pH试纸测定溶液的pH | |
| B. | 向a点所示溶液中通入SO2,溶液的酸性和漂白性均增强 | |
| C. | c点所示溶液中:c(Na+)=2c(ClO-)+c(HClO) | |
| D. | 由a点到b点的过程中,溶液中$\frac{c({H}^{+})}{c(CI{O}^{-})}$减小 |
5.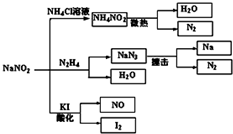 亚硝酸钠(NaNO2)是一种具有咸味、有毒,且价格比食盐(NaCl)便宜的工业用盐,常被误作食盐使用,导致多起中毒事故发生.它的部分性质如图,下列说法错误的是( )
亚硝酸钠(NaNO2)是一种具有咸味、有毒,且价格比食盐(NaCl)便宜的工业用盐,常被误作食盐使用,导致多起中毒事故发生.它的部分性质如图,下列说法错误的是( )
 亚硝酸钠(NaNO2)是一种具有咸味、有毒,且价格比食盐(NaCl)便宜的工业用盐,常被误作食盐使用,导致多起中毒事故发生.它的部分性质如图,下列说法错误的是( )
亚硝酸钠(NaNO2)是一种具有咸味、有毒,且价格比食盐(NaCl)便宜的工业用盐,常被误作食盐使用,导致多起中毒事故发生.它的部分性质如图,下列说法错误的是( )| A. | 可用淀粉碘化钾试纸和食醋鉴别食盐(NaCl)与亚硝酸钠(NaNO2) | |
| B. | N2H4极易溶于水,因为它是极性分子且与水分子之间易形成氢键 | |
| C. | NaNO2与N2H4生成NaN3的反应方程式为:NaNO2+N2H4═NaN3+2H2O | |
| D. | 如图所涉及到的化学反应都是氧化还原反应 |
12.生活中处处有化学,应用物质性质对下列物质用途的解释不正确的是( )
| A | B | C | D | |
| 用途 | 热的纯碱溶液可去油污 | 明矾可用于净水 | 抗坏血酸(Vc)可作抗氧化剂 | 液氨可做制冷剂 |
| 解释 | 纯碱水解呈碱性 | 明矾在水中生成的氢氧化铝胶体有吸附性 | Vc具有酸性 | 液氨汽化时吸收大量的热 |
| A. | A | B. | B | C. | C | D. | D |
 涤、干燥,连接下列装置进行实验,验证阴极产物,
涤、干燥,连接下列装置进行实验,验证阴极产物,