题目内容
5.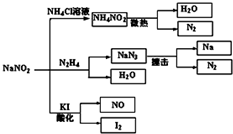 亚硝酸钠(NaNO2)是一种具有咸味、有毒,且价格比食盐(NaCl)便宜的工业用盐,常被误作食盐使用,导致多起中毒事故发生.它的部分性质如图,下列说法错误的是( )
亚硝酸钠(NaNO2)是一种具有咸味、有毒,且价格比食盐(NaCl)便宜的工业用盐,常被误作食盐使用,导致多起中毒事故发生.它的部分性质如图,下列说法错误的是( )| A. | 可用淀粉碘化钾试纸和食醋鉴别食盐(NaCl)与亚硝酸钠(NaNO2) | |
| B. | N2H4极易溶于水,因为它是极性分子且与水分子之间易形成氢键 | |
| C. | NaNO2与N2H4生成NaN3的反应方程式为:NaNO2+N2H4═NaN3+2H2O | |
| D. | 如图所涉及到的化学反应都是氧化还原反应 |
分析 A.亚硝酸钠具有强的氧化性,酸性环境下能够与碘化钾发生氧化还原反应生成碘单质;
B.含N、O、F的氢化物可形成氢键,氢键影响水溶性;
C.依据图中转化关系可知:NaNO2与N2H4生成NaN3和水,反应中N元素化合价由+3价、-2价变为-$\frac{1}{3}$价;
D.氧化还原反应必须有化合价的变化.
解答 解:A.依据图中转化关系可知,亚硝酸钠在酸性环境下能够氧化碘化钾生成单质碘,碘与到淀粉变蓝,氯化钠和KI不反应,可以用来鉴别氯化钠和亚硝酸钠,故A正确;
B.肼和水分子都是极性分子,且二者之间能形成氢键,所以促进肼溶解,故B正确;
C.NaNO2与N2H4生成NaN3和水,反应中N元素化合价由+3价、-2价变为-$\frac{1}{3}$价,依据得失电子守恒,反应方程式为:NaNO2+N2H4═NaN3+2H2O,故C正确;
D.从图中转化关系可知亚硝酸钠与氯化铵溶液反应生成亚硝酸氨和氯化钠,属于复分解反应,不存在元素化合价变化,不属于氧化还原反应,故D错误;
故选:D.
点评 本题主要考查了亚硝酸钠的性质和氧化还原的知识,解题关键在于准确把握图中转化关系,熟悉发生的化学反应,题目难度中等.

练习册系列答案
相关题目
15.向BaCl2溶液中通入物质的量之比为1:2的某混合气体,无沉淀产生,则该混合气体是( )
| A. | Cl2和SO2 | B. | CO2和NH3 | C. | NO和SO2 | D. | NO2和SO2 |
16. 有一种瓦斯分析仪能够在煤矿巷道中的甲烷达到一定浓度时,通过传感器显示出来.该瓦斯分析仪工作原理类似燃料电池的工作原理,其装置如图所示,其中的固体电解质是Y2O3-Na2O,O2-可以在其中自由移动.下列有关叙述正确的是( )
有一种瓦斯分析仪能够在煤矿巷道中的甲烷达到一定浓度时,通过传感器显示出来.该瓦斯分析仪工作原理类似燃料电池的工作原理,其装置如图所示,其中的固体电解质是Y2O3-Na2O,O2-可以在其中自由移动.下列有关叙述正确的是( )
 有一种瓦斯分析仪能够在煤矿巷道中的甲烷达到一定浓度时,通过传感器显示出来.该瓦斯分析仪工作原理类似燃料电池的工作原理,其装置如图所示,其中的固体电解质是Y2O3-Na2O,O2-可以在其中自由移动.下列有关叙述正确的是( )
有一种瓦斯分析仪能够在煤矿巷道中的甲烷达到一定浓度时,通过传感器显示出来.该瓦斯分析仪工作原理类似燃料电池的工作原理,其装置如图所示,其中的固体电解质是Y2O3-Na2O,O2-可以在其中自由移动.下列有关叙述正确的是( )| A. | 电极a是正极,电极反应式为CH4+4O2--8e-=CO2+2H2O | |
| B. | 电极b是正极,O2-由电极b流向电极a | |
| C. | 瓦斯分析仪工作时,电池内电路中电子由电极a流向电极b | |
| D. | 当电路中有0.4mol电子转移时,a极有2.24L(标况)甲烷放电 |
20.下列实验、现象及相关结论均正确的是( )
| A | B | C | D | |
| 实验 | 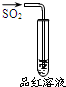 | 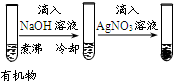 |  | 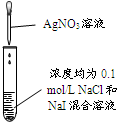 |
| 现象 | 品红褪色 | 最后试管有浅黄色沉淀 | 最后一滴溶液使酚酞由无色变为粉红色,且30秒不复原 | 出现白色沉淀 |
| 结论 | SO2有强氧化性 | 有机物中含有溴原子 | 滴定达到终点 | Ksp(AgCl)>Ksp(AgI) |
| A. | A | B. | B | C. | C | D. | D |
14.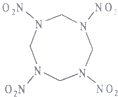 高能材料HMX(结构如图所示)可作核武器的超爆装药和固体火箭推进剂的组分,爆炸时产生氢气、二氧化碳、水.下列说法正确的是( )
高能材料HMX(结构如图所示)可作核武器的超爆装药和固体火箭推进剂的组分,爆炸时产生氢气、二氧化碳、水.下列说法正确的是( )
 高能材料HMX(结构如图所示)可作核武器的超爆装药和固体火箭推进剂的组分,爆炸时产生氢气、二氧化碳、水.下列说法正确的是( )
高能材料HMX(结构如图所示)可作核武器的超爆装药和固体火箭推进剂的组分,爆炸时产生氢气、二氧化碳、水.下列说法正确的是( )| A. | HMX分子式为C4N8O8 | |
| B. | HMX中,所有C、N原子共平面 | |
| C. | 爆炸反应是,N2既是还原产物又是氧化产物 | |
| D. | 29.6gHMX完全燃烧产生二氧化碳8.96L |
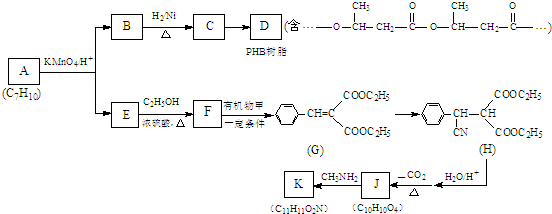
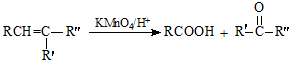
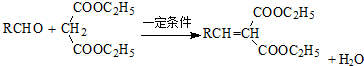
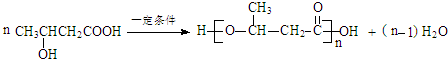 .
. .
.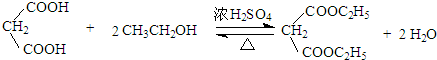 .
.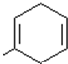 .
.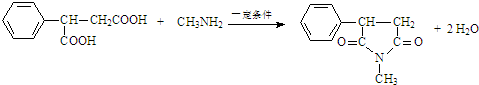 .
.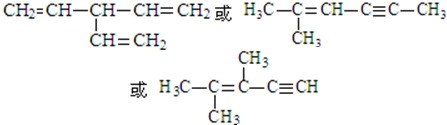 (写出一种即可).
(写出一种即可).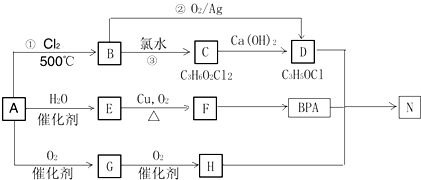
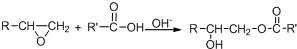
 .
.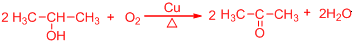 .
.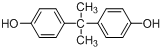 所示,下列说法正确的是ab.
所示,下列说法正确的是ab. .
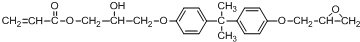
.
 (其中两种).
(其中两种).