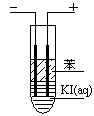
题目内容
1200℃时可用反应 2BBr3(g)+ 3H2(g) 2B(s) + 6HBr(g) 来制取晶体硼。完成下列填空:
2B(s) + 6HBr(g) 来制取晶体硼。完成下列填空:
(1)下列说法能说明该反应达到平衡的是______(选填序号,下同)。
a. v正(BBr3)= 3v逆(HBr) b. 2c(H2) = c(HBr)
c.密闭容器内压强不再变化 d. 容器内气体平均摩尔质量不再变化
(2)若密闭容器体积不变,升高温度,晶体硼的质量增加,下列说法正确的是_________。
a. 在平衡移动时正反应速率先增大后减小
b. 在平衡移动时逆反应速率始终增大
c. 正反应为放热反应
d. 达到新平衡后反应物不再转化为生成物
(3)若上述反应在10L的密闭容器内反应,5min后,气体总质量减少1.1 g,则该时间段内氢气的平均反应速率为__________________。
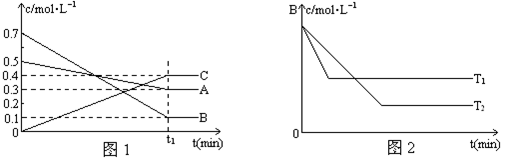
(4)往容器中充入0.2 mol BBr3和一定量H2,充分反应达到平衡后,混合气体中HBr百分含量与起始通入H2的物质的量有如图关系。在a、b、c三点中,H2 的转化率最高的是______(选填字母)。b点达到平衡后,再充入H2使平衡到达c点,此过程中平衡移动的方向为__________(填“正向”、“逆向”或“不移动”)。
(本题共8分)(1) cd(2分);(2)ab(2分);
(3)0.003mol/(L·min)(2分);(4)a(1分),正向(1分)
解析试题分析:(1)在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态。a.v正(BBr3)=3v逆(HBr),说明二者的反应速率方向相反,但不能满足反应速率之比是相应的化学计量数之比,应该是3v正(BBr3)=v逆(HBr)时可以说明,a不正确;b.2c(H2)=c(HBr)满足反应速率之比是相应的化学计量数之比,但不能确定反应的方向,因此不一定能说明,b不正确;c.反应是体积增大的可逆反应,因此当密闭容器内压强不再变化时可以说明反应达到平衡状态,c正确;d.混合气的平均相对分子质量是混合气的质量和混合气的总的物质的量的比值,质量和物质的量都是变化的,所以容器内气体平均摩尔质量不再变化时可以说明达到平衡状态,d正确,答案选cd。
(2)若密闭容器体积不变,升高温度,晶体硼的质量增加,这说明平衡向正反应方向移动,因此正方应是吸热反应。a.升高温度,平衡向正反应方向移动,所以在平衡移动时正反应速率先增大后减小,a正确;b. 升高温度,平衡向正反应方向移动,所以在平衡移动时逆反应速率始终增大,b正确;c.正反应为吸热反应,c不正确;d.达到新平衡后正逆反应速率相等,但不为0,所以反应物不再转化为生成物是错误的,d不正确,答案选ab。
(3)根据方程式可知:2BBr3(g)+ 3H2(g) 2B(s) + 6HBr(g) △m↓
2B(s) + 6HBr(g) △m↓
3mol 22g
0.15mol 1.1g
因此消耗氢气的浓度是0.15mol÷10L=0.015mol/L
所以氢气的反应速率=0.015mol/L÷5min=0.003mol/(L·min)
(4)在BBr3的物质的量固定的条件下,氢气的量越多,BBr3的转化率越高而氢气的转化率越低,因此根据图像可知,氢气转化率最高的是a点;b点达到平衡后,再充入H2使平衡到达c点,增大反应物浓度平衡向正反应方向越低,因此在此过程中平衡移动的方向为正向。
考点:考查可逆反应平衡状态判断、外界条件对反应速率和平衡状态的影响、反应速率计算以及图像识别等

碳单质在工业上有多种用途。例如焦炭可用来制取水煤气、冶炼金属,活性炭可处理大气污染物NO。
一定条件下,在2 L密闭容器中加入NO和活性炭(无杂质)反应生成气体A和B。当温度在T1℃时,测得各物质平衡时物质的量如下表:
| | 活性炭 (mol) | NO (mol) | A (mol) | B (mol) |
| 初始 | 2.030 | 0.100 | 0 | 0 |
| 平衡 | 2.000 | 0.040 | 0.030 | 0.030 |
(1)在T1℃时,达到平衡共耗时2分钟,则NO的平均反应速率为 mol/(L·min);当活性炭消耗0.015mol时,反应的时间 (填“大于”、“小于”或“等于”)1分钟。
(2)在T1℃下反应达到平衡后,下列措施不能改变NO的转化率的是 。
a.增大活性炭的量 b.增大压强 c.升高温度 d.移去部分B
(3)结合上表数据,该反应的平衡常数表达式为 。(生成物A、B用相应的化学式表示)若T1℃时的平衡常数为K1,T2℃时的平衡常数为K2,且K1>K2,能否判断该反应是吸热反应还是放热反应,说明理 。
(1)将一定量纯净的氨基甲酸铵置于密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:
H2NCOONH4(s) 2NH3(g)+CO2(g)
2NH3(g)+CO2(g)
实验测得不同温度下的平衡数据列于下表:
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡气体总浓度(×10—3 mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
①氨基甲酸铵分解反应的焓变△H 0(填“>”、“<”或“=”)。
②可以判断该分解反应已经达到化学平衡的是____。
A.2v(NH3)=v(CO2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
③根据表中数据,计算25.0℃时的分解平衡常数为 。
(2)25℃时,NH3.H2O电离常数Kb=1.8×10—5,Mg(OH)2的溶度积常数Ksp=1.8×10—11,用pH计测得0.5 mol/L氨水溶液的pH约为 。在某氯化镁溶液中加入一定量的某浓度的烧碱后,测得混合液pH =11.0,则此温度下残留在溶液中的c(Mg2+)=____。(已知lg2≈0.3、lg3≈0.5)。
(13分)
Cl2是一种重要的化工原料。
(1)电解饱和NaCl溶液获得Cl2的化学方程式是_______。
(2)为便于储存,要将氯气液化[ Cl2(g)  Cl2(l) ],应采取的措施是_______(写出一条即可)。
Cl2(l) ],应采取的措施是_______(写出一条即可)。
(3)液氯储存区贴有的说明卡如下(部分):
| 危险性 |  |
| 储运要求 | 远离金属粉末、氨、烃类、醇更物质;设置氯气检测仪 |
| 泄漏处理 | NaOH、NaHSO3溶液吸收 |
| 包装 | 钢瓶 |
② 若液氯泄漏后遇到苯,在钢瓶表面氯与苯的反应明显加快,原因是 。
③ 氯气含量检测仪工作原理示意图如下:
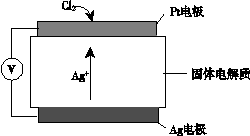
Cl2在Pt电极放电的电极反应式是_______。
(4)质量标准要求液氯含水量(以1 g氯气含水的质量计)<0. 4 mg,含水量超标会严重腐蚀钢瓶。液氯含水量的测定装置如下图所示:

(已知:P2O5 + 3H2O = 2H3PO4;Cl2与P2O5不反应。)
① 用离子方程式说明c装置的作用_______。
② 检测液氯的含水量,根据上图,需要测定的数据是_______。
 s后达平衡。如图:
s后达平衡。如图:

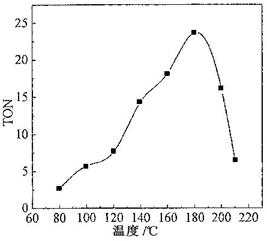
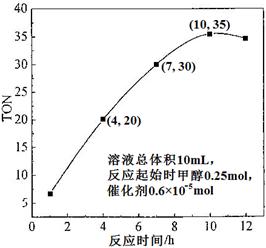
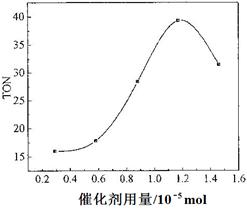
 NH3(g) + HI(g)
NH3(g) + HI(g)