题目内容
碘及其化合物在生产、生活中具有广泛的用途。解答下列与碘元素有关的试题:
(1)碘是人体中的微量元素之一,是一种智力元素。国家推广“加碘食盐”,其中一般加入的是KIO3,而不是KI。其原因是 。
(2)常温下,NH4I是一种固体,一定温度下在密闭容器中发生下面的反应:
① NH4I(s) 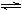 NH3(g) + HI(g)
NH3(g) + HI(g)
② 2HI(g) 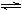 H2(g) + I2(g)
H2(g) + I2(g)
达到平衡时,缩小容器体积,增大体系压强,混合气体的颜色 (填“加深”或“变浅”或“不变”);达到平衡时,反应②的化学平衡常数表达式为 ;达到平衡时c(H2)=0.5mol/L,反应①的化学平衡常数为20,则 c (HI) = 。
(3)如图,在粗试管中加入饱和的KI溶液,然后再加入苯,插入两根石墨电极,接通直流电源。连接电源负极的电极为 极,电极反应式为 。通电一段时间后,断开电源,振荡试管,上层溶液为 色。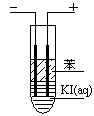
(4)已知Ksp(PbI2)=7.1×10-9mol3/L3。在盛有澄清的PbI2饱和溶液的试管中,滴加浓度为0.1mol/L的碘化钾溶液,振荡,可以观察到溶液中有黄色浑浊产生,这些黄色浑浊的成分是 。
(1)KI在空气中容易被氧气氧化,而KIO3比较稳定 (2分)
(2)加深 (2分) c(H2)·c(I2)/ c2 (HI) (2分) 4mol/L (2分)
(3)阴 (1分) 2H2O + 2e﹣ = 2OH﹣ + H2↑(2分) 紫红色(2分)
(4)PbI2(2分)
解析试题分析:(1)KI在空气中容易被氧气氧化变质,生成有害物质;而KIO3比较稳定;(2)达到平衡时,缩
小容器体积,增大体系压强,混合气体的颜色肯定是变深的。反应①的平衡常数k=c(NH3)?c(HI);
反应②的平衡常数k=c(H2)·c(I2)/ c2 (HI) ;由反应②可知分解的c(HI)为平衡时c(H2)的
2倍,平衡时c(HI)=xmol?L-1,则氨气的物质的量浓度为:c(NH3)=(x+1)mol?L-1,
代入反应①的平衡常数k=c(NH3)?c(HI)=(x+1)·x=20计算,得到平衡时c(HI)=4mol?L-1。
与电源负极相连的为阴极,阳离子H+放电, 2H2O + 2e﹣ = 2OH﹣ + H2↑;阳极,阴离子
I-放电:2I- -2e﹣ =I2 ,上层是溶有碘的苯层,显紫红色。(4)Ksp(PbI2)=c(Pb2+)c(I-)2 = 7.1×10-9mol3/L3;c(Pb2+)=1.53×10-3mol/L,c(I-)=2.06×10-3mol/L,滴加浓度为0.1mol/L的碘化钾溶液,振荡,可以观察到溶液中有黄色PbI2浑浊产生。
考点:本题综合性很强,考查有化学平衡常数、电解方程式书写和溶度积常数。

 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
I.800℃时,向容积为2L的恒容密闭容器中充入一定量的CO和H2O维持恒温,发生反应CO(g)+H2O(g) H2(g)+CO2(g),反应过???中测定的部分数据见下表:
H2(g)+CO2(g),反应过???中测定的部分数据见下表:
| 反应时间/min | 0 | 2 | 4 | 6 |
| n(CO)/mol | 1.20 | 0.90 | | 0.80 |
| n(H2O)/ mol | 0.60 | | 0.20 | |
②800℃时,化学平衡常数K的值为______________;
③保持其他条件不变,向平衡体系中再通入0.20 mol H2O,与原平衡相比,达到新平衡时CO转化率______(填“增大”或“减小”或“不变”)。
④在恒温恒压密闭容器中通入CO和H2O各1 mol发生该反应,当反应达到平衡后,维持温度与压强不变,t1时再通入各1 mol的CO和H2O的混合气体,请在下图中画出正(v正)、逆(v逆)反应速率在t1后随时间t变化的曲线图。

II.实验室中利用复分解反应制取Mg(OH)2。实验数据和现象如下表所示(溶液体积均取用1mL):

①现象III是 ;
②如果向0.028 mol/L的MgCl2溶液中加入等体积的NaOH溶液,请计算NaOH溶液的浓度至少达到 mol/L时,溶液中开始出现白色沉淀(Ksp(Mg(OH)2)= 5.6×10-12)。
③MgCl2溶液和氨水混合后存在下列化学平衡:
Mg2+(aq) + 2NH3·H2O(aq)
 2NH4+(aq) + Mg(OH)2(s)该反应化学平衡常数的表达式为K= ,列出该反应平衡常数K与Kb(NH3·H2O)、Ksp(Mg(OH)2)的关系式 。
2NH4+(aq) + Mg(OH)2(s)该反应化学平衡常数的表达式为K= ,列出该反应平衡常数K与Kb(NH3·H2O)、Ksp(Mg(OH)2)的关系式 。  pC达到平衡,若:
pC达到平衡,若:
 2B(s) + 6HBr(g) 来制取晶体硼。完成下列填空:
2B(s) + 6HBr(g) 来制取晶体硼。完成下列填空:
 N2O3(g) ΔH<0
N2O3(g) ΔH<0 
 C(g)+D(g)达到平衡后,升高温度容器内气体的密度增大。请回答下列问题:
C(g)+D(g)达到平衡后,升高温度容器内气体的密度增大。请回答下列问题:
 2NO(g),是导致汽车尾气中含有NO的原因之一。
2NO(g),是导致汽车尾气中含有NO的原因之一。
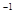 的醋酸与b mol
的醋酸与b mol L
L