题目内容
【题目】氮化铝(AlN)是一种耐高温、抗冲击、导电性好的优良工业材料。现通过反应:Al2O3+3C+N2![]() 2AlN+3CO来制取,下列有关该反应的说法中正确的是
2AlN+3CO来制取,下列有关该反应的说法中正确的是
A.Al2O3中Al元素化合价没有发生变化B.N2是氧化剂
C.CO作还原剂D.反应物C发生还原反应
【答案】AB
【解析】
Al2O3+N2+3C![]() 2AlN+3CO,反应中碳元素的化合价由0升高到+2价,氮元素的化合价由0价降低为-3价,结合氧化还原反应的规律分析解答。
2AlN+3CO,反应中碳元素的化合价由0升高到+2价,氮元素的化合价由0价降低为-3价,结合氧化还原反应的规律分析解答。
A、反应中碳元素的化合价由0升高到+2价,氮元素的化合价由0价降低为-3价,Al2O3中Al元素化合价没有发生变化,故A正确;
B、因氮元素的化合价由0降低为-3价,被还原,N2是氧化剂,故B正确;
C、反应中碳元素的化合价由0升高到+2价,CO作氧化产物,故C错误;
D、反应中碳元素的化合价由0升高到+2价,反应物C发生氧化反应,故D错误;
故选AB。

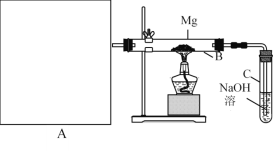
【题目】氯气可用于制取漂白剂和自来水消毒。
(1)将氯气通入水中制得氯水,氯水可用于漂白,其中起漂白作用的物质是________(填写化学式)。
(2)“84”消毒液也可用于漂白,其工业制法是控制在常温条件下,将氯气通入NaOH溶液中,反应的离子方程式为______________________。
(3)同学们探究“84”消毒液在不同pH下使红纸褪色的情况,做了如下实验:
步骤1:将5 mL市售“84”消毒液稀释100倍,测得稀释后溶液的pH=12;
步骤2:将稀释后溶液各20 mL分别加入3个洁净的小烧杯中;
步骤3:用H2SO4溶液将3个烧杯内溶液的pH分别调至10、7和4。(溶液体积变化忽略不计)
步骤4:在3个烧杯中分别放入大小相同的红纸,观察现象,记录如下:
烧杯 | 溶液的pH | 现象 |
a | 10 | 10 min后,红纸基本不褪色;4 h后红纸褪色 |
b | 7 | 10 min后,红纸颜色变浅;4 h后红纸褪色 |
c | 4 | 10 min后,红纸颜色变得更浅;4 h后红纸褪色 |
已知,溶液中Cl2、HClO和ClO-物质的量分数(α)随溶液pH变化的关系如下图所示:
![]()

①由实验现象可获得以下结论:溶液的pH在4~10范围内,pH越大,红纸褪色________。
②结合图像进行分析,b、c两烧杯中实验现象出现差异的原因是________。
(4)由于氯气会与自来水中的有机物发生反应生成对人体有害的物质,人们尝试研究并使用新的自来水消毒剂,如ClO2气体就是一种新型高效含氯消毒剂。
①一种制备ClO2的方法是用SO2通入硫酸酸化的NaClO3溶液中,反应的离子方程式为________。
②另一种制备ClO2的方法是用NaClO3与盐酸反应,同时有Cl2生成,产物中Cl2体积约占1/3,每生成0.5 mol ClO2,转移________mol e-。
【题目】探究金属钠与水或盐酸的反应记录如下。
实验序号 | 实验内容 | 实验现象 |
I | 0.23g钠与20mL蒸馏水 | 钠浮在水面上,熔成小球四处游动,发出嘶嘶响声,20s后钠块消失 |
II | 0.23g纳与20ml | 钠浮在水面上,熔成小球四处游动,发出嘶嘶响声,13s后钠块消失 |
(1)由实验现象可推断:金属钠与水成盐酸的反应,反应的共同特征是__________(写出两点)。
(2)研究实验I
①实验前水中![]() ______________。
______________。
②实验结束后所得溶液显碱性,原因可能是____________(填序号)。
a.生成的氢氧化钠属于碱
b.氢氧化钠在水中能电离出![]()
c.氢氧化钠抑制了水的电离,导致由水电离产生的![]()
d.钠与![]() 反应,促进水的电离,导致
反应,促进水的电离,导致![]()
(3)研究实验II
①实验前溶液pH=_____________
②实验结束后,溶液中离子浓度由大到小的顺序是_____________