题目内容
【题目】由N、P、S、Cl、Ni等元素组成的新型材料有着广泛的用途,请回答下列问题:
(1)基态N的原子核外___种运动状态不同的电子,基态 P原子核外电子排布式为_____,P、S、Cl的第一电离能由大到小顺序为___。
(2)PCl3分子中的中心原子杂化轨道类型是__,该分子构型为____。
(3)PCl3 是一种无色的液体,遇水容易水解生成两种酸,则方程式__。
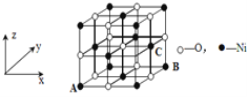
(4)已知MgO与NiO的晶体结构(如图)相同, 其中Mg2+和Ni2+的离子半径分别为66 pm和69pm。则熔点:MgO___NiO(填“>”、“<”或“=”),理由是__。
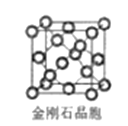
(5)金刚石晶胞含有__个碳原子。若碳原子半径为r,金刚石晶胞的边长为a,根据硬球接触模型,则r=___a,列式表示碳原子在晶胞中的空间占有率___(请用r和a表示不要求计算结果)。
【答案】7 1s22s22p63s23p3 Cl>P>S sp3 三角锥形 PCl3+3H2O=H3PO3+3HCl > Mg2+半径比Ni2+小,MgO晶格能比NiO大 8 ![]()
![]()
【解析】
(1)基态N的原子核外有7个电子,每个电子的能量不同,不运动状态也不同。故有7种运动状态不同的电子。基态 P原子为15号元素,核外电子排布式为1s22s22p63s23p3;P、S、Cl为同周期元素,同周期随原子序数增大,元素第一电离能呈增大趋势,P元素原子3p能级为半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能:Cl>P>S。
答案为:7;1s22s22p63s23p3;Cl>P>S;
(2)根据价电子理论,PCl3分子中的中心原子的价电子对数=![]() ,杂化轨道类型是sp3杂化,该分子4个原子构成,空间构型为三角锥形。
,杂化轨道类型是sp3杂化,该分子4个原子构成,空间构型为三角锥形。
答案为:sp3;三角锥形;
(3)PCl3遇水容易水解生成亚磷酸和盐酸,方程式PCl3+3H2O=H3PO3+3HCl。
答案为:PCl3+3H2O=H3PO3+3HCl;
(4)Mg2+半径比Ni2+小,MgO晶格能比NiO大,晶格能越大,熔沸点越高。
答案为:>;Mg2+半径比Ni2+小,MgO晶格能比NiO大;
(5)金刚石晶胞中各个顶点、面上和体内的原子数目依次为8、6、4,然后依据晶胞计算确定在晶体中碳原子数目,碳原子数目为n=8×1/8+6×1/2+4=8;根据硬球接触模型可以确定,正方体对角线的![]() 就是C-C键的键长,体对角线四分之一处的原子与顶点上的原子紧贴,晶胞正方体对角线长度=
就是C-C键的键长,体对角线四分之一处的原子与顶点上的原子紧贴,晶胞正方体对角线长度=![]() ,因此有
,因此有![]() ,所以r=
,所以r=![]() ;碳原子在晶胞中的空间占有率=
;碳原子在晶胞中的空间占有率=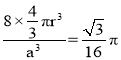 ,
,
答案为![]() ;
;![]() 。
。