题目内容
【题目】云南省曲靖的铬渣污染经媒体报道后,铬污染再次引起人们的关注。利用化学原理可以对工厂排放的含铬废水、铬渣等进行有效处理。
Ⅰ.含铬废水的处理:某企业排放的含铬废水中含有较多毒性较大的Cr2O![]() ,某研究性学习小组为了变废为宝,将废水处理得到金属铬,设计了如下的工艺流程。
,某研究性学习小组为了变废为宝,将废水处理得到金属铬,设计了如下的工艺流程。
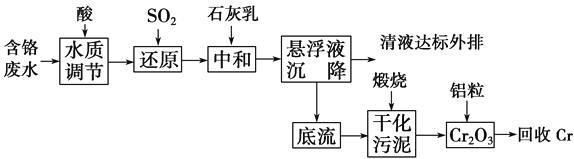
(1)请写出通入SO2时发生的离子反应:______________________________________。
(2)写出加入铝粒时发生反应的化学方程式____________________________________。
Ⅱ.铬渣的处理
铬渣烧结炼铁法:铬渣中约含有55%的氧化钙和氧化镁,此外还含有15%左右的氧化铁,这些都是炼铁所需的成分。少量的铬渣代替消石灰同铁矿粉、煤粉混合,经烧结后送入高炉冶炼,六价铬还原为三价铬或金属铬,金属铬熔入铁水,而其他成分熔入熔渣。炼铁可使铬渣彻底解毒并充分利用,是铬渣治理的良好方法之一。
碱性溶液还原法:直接在碱性铬渣中加入硫化钠等进行六价铬的还原反应,形成Cr(OH)3沉淀后,过滤回收铬污泥。
(3)铬渣烧结炼铁法中煤粉的作用是____________。(写两点)
(4)请配平碱性溶液还原法中发生的离子反应:_______________
![]() Cr2O72-+
Cr2O72-+![]() S2-+
S2-+![]() H2O===
H2O===![]() Cr(OH)3↓+
Cr(OH)3↓+![]() S2O32-+
S2O32-+![]() OH-
OH-
(5)用足量的CO还原14 g铁的氧化物的混合物,将生成的气体通入足量的澄清石灰水中,生成沉淀25 g,则这种混合物可能是________(填序号);
①FeO、Fe2O3 ②FeO、Fe3O4 ③Fe2O3、Fe3O4
在这些混合物中,各成分的物质的量之比是________。
Ⅲ.电解法处理
工业上处理含Cr2O72-离子的酸性废水,采用以下处理方法。①往工业废水中加入适量的食盐(1~2 g·L-1),搅拌均匀;②用Fe为电极进行电解;③鼓入空气,经过一段时间后,使废水中的含铬(有毒)量降到可排放的标准。其原理是:①将Cr2O![]() 离子还原为可溶性三价铬离子;②要在电解除铬过程中,使溶液的pH不断升高,使工业废水由酸性变为碱性,再把三价铬离子变为不溶性氢氧化物除去。
离子还原为可溶性三价铬离子;②要在电解除铬过程中,使溶液的pH不断升高,使工业废水由酸性变为碱性,再把三价铬离子变为不溶性氢氧化物除去。
(6)加入食盐的目的是______________________________________________________;电解时阳极反应式为______________。
【答案】Cr2O72-+3SO2+2H+===2Cr3++3SO42-+H2O 2Al+Cr2O3![]() Al2O3+2Cr 为高炉冶炼过程提供热源;燃烧后生成的CO是高炉冶炼过程的还原剂;还起到高温填料的作用(写两点即可) 4 6 19 8 3 14 ①③ 1∶2或1∶1 增强导电性 Fe-2e-===Fe2+
Al2O3+2Cr 为高炉冶炼过程提供热源;燃烧后生成的CO是高炉冶炼过程的还原剂;还起到高温填料的作用(写两点即可) 4 6 19 8 3 14 ①③ 1∶2或1∶1 增强导电性 Fe-2e-===Fe2+
【解析】
(1)二氧化硫与Cr2O72-离子发生氧化还原反应生成SO42-离子和Cr3+离子;
(2)Al具有强还原性,能够将Cr从其氧化物中还原出来;
(3)煤粉燃烧后生成的CO是高炉冶炼过程的还原剂,为高炉冶炼过程提供热源等;
(4)Cr2O72-→Cr3+,S2-→S2O32-,根据电子转移守恒配平;
(5)可依据铁的氧化物与一氧化碳以及二氧化碳和氢氧化钙反应的方程式推算铁的氧化物的化学式进而对相关选项作出判断;
(6)加入适量的NaCl可增强溶液的导电性;阳极铁失去电子生成亚铁离子。
(1)重铬酸根具有强氧化性,能将二氧化硫中+4价的硫氧化为+6价,离子反应为:Cr2O72-+2H++3SO2═2Cr3++3SO42-+H2O;
(2)根据铝热反应的概念,铝与氧化铬在高温下生成铬和氧化铝,反应方程式为2Al+Cr2O3![]() Al2O3+2Cr;
Al2O3+2Cr;
(3)少量的铬渣代替消石灰同铁矿粉、煤粉混合,经烧结后送入高炉冶炼,煤粉的作用煤粉燃烧后生成的CO是高炉冶炼过程的还原剂,为高炉冶炼过程提供热源,还起到高温填料的作用(写两点即可);
(4)Cr2O72-→Cr3+,1molCr2O72-获得电子物质的量为1mol×2×(6-3)=6mol,S2-→S2O32-,2molS2-失去电子物质的量为1mol×2×[2-(-2)]=8mol,根据电子转移守恒,最小公倍数为24,所以发生的离子反应为:4Cr2O72-+6S2-+19H2O═8Cr(OH)3↓+3S2O32-+14OH-;
(5)假设铁的氧化物的化学式为FexOy,则它与一氧化碳反应的方程式为:FexOy+yCO![]() xFe+yCO2,Ca(OH)2+CO2═CaCO3↓+H2O,所以可建立FexOy~yCO2~yCaCO3的关系式;
xFe+yCO2,Ca(OH)2+CO2═CaCO3↓+H2O,所以可建立FexOy~yCO2~yCaCO3的关系式;
则有FexOy~yCO2~yCaCO3
56x+16y 100y
14g25g
![]() =
=![]() ,解得:
,解得:![]() =
=![]() ,则两元素的质量比为56×5:16×7=5:2,而FeO、Fe2O3、Fe3O4三者中铁与氧的质量比分别是:7:2;7:3;21:8;所以可推断该物质中一定会含有Fe2O3;故答案为①③;
,则两元素的质量比为56×5:16×7=5:2,而FeO、Fe2O3、Fe3O4三者中铁与氧的质量比分别是:7:2;7:3;21:8;所以可推断该物质中一定会含有Fe2O3;故答案为①③;
若为①FeO、Fe2O3,设FeO的物质的量为xmol,Fe2O3的物质的量为ymol,则:(56x+112y):(16x+48y)=5:2,解得:x:y=1:2;
若为③Fe2O3、Fe3O4,设Fe2O3的物质的量为xmol,Fe3O4的物质的量为ymol,则:(112x+168y):(48x+64y)=5:2,解得:x:y=1:1;
(6)因NaCl为电解质,加入适量的NaCl可增强溶液的导电能力;Fe为阳极,则阳极铁失去电子生成亚铁离子,所以阳极反应为:Fe-2e-=Fe2+。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案