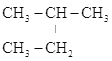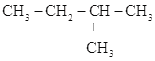题目内容
【题目】按要求回答下列问题:
(1)如图所示物质的有关结构,请回答:
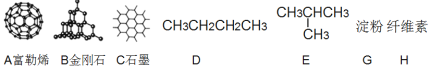
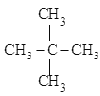
①A、B、C三者的关系为_________(填写序号)。
a.同分异构体b.同素异形体c.同一种物质d.同位素
②固态时,A属于__________晶体(填“离子”、“原子”或“分子”)。
③有同学认为D、E互为同分异构体而G、H两者并不是同分异构体的关系。这句话正确吗?答:__________(填写“正确”或“不正确”)
④有机物E用系统命名法命名的名称是__________。
(2)已知下列7种物质:a.P4(白磷) b.SiO2 c.NH4Cl d.NaOH e.NaCl f.干冰 g.金刚石,固态时它们都为晶体,回答下列问题:(填写序号)
①晶体中既有离子键又有共价键的是__________
②熔化时只需要破坏共价键的是__________
③熔点最高的晶体是__________,沸点最低的晶体是__________
【答案】b 分子 正确 2-甲基丙烷 cd bg g f
【解析】
由同种元素构成的不同种分子互称为同素异形体;由分子构成的晶体叫做分子晶体;分子式相同而结构不同的两种化合物互称为同分异构体;原子晶体的熔沸点最高,离子晶体次之,分子晶体的熔沸点最低。
(1)①ABC均是有C元素构成的物质,三者互称同素异形体,b正确;
②A为富勒烯,是分子,故晶体类型为分子晶体;
③DE分子式相同而结构不同,二者互称同分异构体,但是GH二者分子式不同,故不能互称同分异构体;
④选择最长碳链为主链,分子中最长碳链为3个碳,为丙烷,其中二号碳上存在一个支链,故E物质的系统命名为2-甲基丙烷;
(2)a.P4(白磷)由白磷分子构成,为分子晶体;b.SiO2由Si和O以共价键形式结合,为原子晶体;c.NH4Cl由离子键构成,铵根离子中存在共价键,氯化铵为离子晶体;d.NaOH由离子键构成,氢氧根中存在共价键,氢氧化钠为离子晶体;e.NaCl存在离子键,为离子晶体;f.干冰由二氧化碳分子构成,为分子晶体;g.金刚石,由碳以共价键形式结合,为原子晶体;
①根据上述分析,晶体中既有离子键又有共价键的是cd;
②根据上述分析,熔化时只需要破坏共价键的是bg;
③晶体中原子晶体的熔点相对于其他晶体来说为最高,由于金刚石中C-C键的键长较Si-O键的键长短,因此C-C键的键能较大,金刚石的熔点较SiO2的熔点高,故熔点最高的晶体是g;晶体中分子晶体沸腾时只需要克服分子间作用力,而分子间作用力相对其他粒子间的相互作用小得多,,故分子晶体的沸点为晶体中最低,白磷和二氧化碳均为分子晶体,但常温下白磷为固体,二氧化碳为气体,故沸点最低的晶体是f。