题目内容
【题目】硝酸是一种重要的化工原料,工业上采用氨催化氧化法制备,生产过程中发生的反应有:
NH3(g)+![]() O2(g)
O2(g)![]() NO(g)+
NO(g)+![]() H2O(l) △H1= -292.3kJ/mol
H2O(l) △H1= -292.3kJ/mol
NO(g)+![]() O2(g)= NO2(g) △H2= -57.1kJ/mol
O2(g)= NO2(g) △H2= -57.1kJ/mol
3NO2(g)+ H2O(l)=2HNO3(aq)+NO(g) △H3= -71.7kJ/mol
回答以下问题:
(1) NH3(g)+2O2(g)=HNO3(aq)+ H2O(l) 的 △H= ___________ kJ/mol。原料气体(NH3、O2)在进入反应装置之前,必须进行脱硫处理。其原因是____。
(2)研究表明2NO(g)+ O2(g)![]() 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:
(a)2NO(g)![]() N2O2(g)(快) (b)N2O2(g)+ O2(g)
N2O2(g)(快) (b)N2O2(g)+ O2(g)![]() 2NO2(g)(慢)
2NO2(g)(慢)
①该反应的速率由b步决定,说明b步反应的活化能比a步的 ___(填“大”或“小”)。
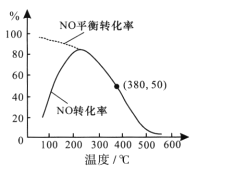
②在恒容条件下,NO和O2的起始浓度之比为2:1,反应经历相同时间,测得不同温度下NO转化为NO2的转化率如图,则150℃时,v正___ v逆(填“>”或“<”)。若起始c(O2)=5.0×10-4mol/L,则380℃下反应达平衡时c(O2)=____mol/L。
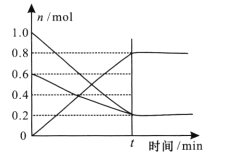
(3) T1温度时,在容积为2L的恒容密闭容器中发生反应2NO+ O2![]() 2NO2,实验测得:v正=v(NO)消耗=2v(O2)消耗=k正c2(NO)·c(O2),v逆=v(NO2)消耗=k逆c2(NO2),k正、k逆为速率常数,受温度影响。容器中各反应物和生成物的物质的量随时间变化如下图所示:
2NO2,实验测得:v正=v(NO)消耗=2v(O2)消耗=k正c2(NO)·c(O2),v逆=v(NO2)消耗=k逆c2(NO2),k正、k逆为速率常数,受温度影响。容器中各反应物和生成物的物质的量随时间变化如下图所示:
①下列说法能表明该反应已经达到平衡状态的是 ____填序号)
A. 混合气体的密度不变 B. 混合气体的颜色不变
C. k正、k逆不变 D. 2v正(O2)=v逆(NO2)
②化学平衡常数K与速率常数k正、k逆的数学关系式K=____。
③温度为T1时的化学平衡常数K= _____。若将容器的温度变为T2时,k正=k逆,则T2 ___T1(填“>
【答案】-413.8 含硫化合物会引起催化剂中毒(含硫化合物会使催化剂降低或失去催化效果) 大 > 2.5×10-4 BD ![]() 5 >
5 >
【解析】
(1)根据盖斯定律分析计算;含硫化合物会引起催化剂中毒,据此分析解答;
(2)该反应的速率由b步决定,说明b步反应的活化能比较大;根据图像,150℃时,NO的转化率小于NO的平衡转化率,说明反应需要继续正向继续;380℃下反应达平衡时,NO的平衡转化率为50%,据此计算平衡时的c(O2);
(3)①在容积为2L的恒容密闭容器中发生反应2NO+ O2![]() 2NO2,根据平衡状态的特征分析判断;②化学平衡时,正、逆反应速率相等,v正= v逆,结合K的表达式分析计算;③根据图像,计算出温度为T1时,平衡时c(NO)、c(O2)、 c(NO2),再结合化学平衡常数K=
2NO2,根据平衡状态的特征分析判断;②化学平衡时,正、逆反应速率相等,v正= v逆,结合K的表达式分析计算;③根据图像,计算出温度为T1时,平衡时c(NO)、c(O2)、 c(NO2),再结合化学平衡常数K= ![]() 计算;根据K=
计算;根据K=![]() 判断平衡常数的变化,据此判断平衡移动的方向,再判断温度的变化。
判断平衡常数的变化,据此判断平衡移动的方向,再判断温度的变化。
(1)①NH3(g)+![]() O2(g)
O2(g)![]() NO(g)+
NO(g)+![]() H2O(l) △H1= -292.3kJ/mol,②NO(g)+
H2O(l) △H1= -292.3kJ/mol,②NO(g)+![]() O2(g)= NO2(g) △H2= -57.1kJ/mol,③3NO2(g)+H2O(l)=2HNO3(aq)+NO(g) △H3= -71.7kJ/mol,根据盖斯定律,将①+②×
O2(g)= NO2(g) △H2= -57.1kJ/mol,③3NO2(g)+H2O(l)=2HNO3(aq)+NO(g) △H3= -71.7kJ/mol,根据盖斯定律,将①+②×![]() +③×
+③×![]() 得:NH3(g)+2O2(g)=HNO3(aq)+H2O(l) △H=(-292.3kJ/mol)+(-57.1kJ/mol)×
得:NH3(g)+2O2(g)=HNO3(aq)+H2O(l) △H=(-292.3kJ/mol)+(-57.1kJ/mol)×![]() +(-71.7kJ/mol)×
+(-71.7kJ/mol)×![]() = -413.8kJ/mol;含硫化合物会引起催化剂中毒,因此原料气体(NH3、O2)在进入反应装置之前,必须进行脱硫处理,防止含硫化合物引起催化剂中毒;
= -413.8kJ/mol;含硫化合物会引起催化剂中毒,因此原料气体(NH3、O2)在进入反应装置之前,必须进行脱硫处理,防止含硫化合物引起催化剂中毒;
(2)①该反应的速率由b步决定,说明b步反应的活化能比a步的大;
②根据图像,150℃时,NO的转化率小于NO的平衡转化率,说明反应需要继续正向继续,因此v正>v逆;若起始c(O2)=5.0×10-4 mol/L,根据图像,380℃下反应达平衡时,NO的平衡转化率为50%,因此c(O2)= 2.5×10-4mol/L;
(3)①在容积为2L的恒容密闭容器中发生反应2NO+ O2![]() 2NO2,
2NO2,
A. 混合气体的质量和容器的体积均不变,混合气体的密度始终不变,不能说明达到平衡状态,故A错误;
B. 混合气体中只有NO2有色,气体的颜色不变,说明NO2浓度不变,说明达到平衡状态,故B正确;
C. k正、k逆为速率常数,只与温度有关,温度不变,k正、k逆始终不变,不能说明达到平衡状态,故C错误;
D. 2v正(O2)=v逆(NO2)表示正逆反应速率相等,说明达到平衡状态,故D正确;
故答案为:BD;
②化学平衡时,正逆反应速率相等,v正= v逆,即k正c2(NO)·c(O2)k逆c2(NO2),化学平衡常数K=![]() =
=![]() ;
;
③根据图像,温度为T1时,平衡时,c(NO)=![]() =0.4 mol/L,c(O2)=
=0.4 mol/L,c(O2)= ![]() =0.2 mol/L, c(NO2)=
=0.2 mol/L, c(NO2)= ![]() =0.4mol/L,此时化学平衡常数K=
=0.4mol/L,此时化学平衡常数K= ![]() =
=![]() =5;若将容器的温度变为T2时,k正=k逆,即K=
=5;若将容器的温度变为T2时,k正=k逆,即K=![]() =1,平衡常数减小,说明平衡逆向移动,该反应为放热反应,因此T2 >T1。
=1,平衡常数减小,说明平衡逆向移动,该反应为放热反应,因此T2 >T1。

【题目】Cl2是一种重要的工业原料,液氯储存区贴有的说明卡如下:
包装 | 钢瓶 |
储运要求 | 远离金属粉末、氨、烃类、醇类物质;设置氯气检测仪 |
泄漏处理 | NaOH、NaHSO3溶液吸收 |
下列解释事实的方程式不正确的是
A. 电解饱和食盐水制取Cl2:2Cl- +2H2O![]() 2OH-+ H2↑+Cl2↑
2OH-+ H2↑+Cl2↑
B. 氯气用于自来水消毒:Cl2 + H2O![]() 2H+ + Cl-+ ClO-
2H+ + Cl-+ ClO-
C. 浓氨水检验泄露的氯气,产生白烟:8NH3 + 3Cl2 === 6 NH4Cl + N2
D. 氯气“泄漏处理”中NaHSO3溶液的作用:HSO3-+ Cl2 + H2O === SO42-+ 3H+ + 2Cl-