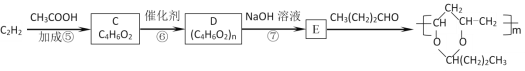题目内容
【题目】某气态烃A与H2的相对密度为14,其产量可以用来衡量一个国家的石油化工发展水平。以该化合物为原料合成化合物G、E和I的流程如下:
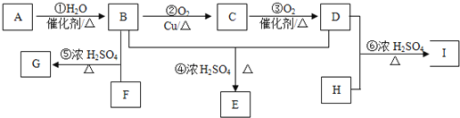
已知:Ⅰ.芳香族化合物F为C、H、O化合物,其相对分子质量为166,环上的一氯代物有一种,1molF与足量NaHCO3溶液反应能生成2molCO2,F与足量B反应生成G。
Ⅱ.H为二元醇,其蒸气密度折算成标准状况为2.77g/L,H与足量D反应生成I。
(1)A中官能团的名称为____________,E的结构简式_________________。
(2)G的分子式为_____________,反应⑤的反应类型为________________。
(3)写出下列化学方程式:②_______________________;
⑥___________________________。
(4)以乙烯为原料合成的加聚产物为![]() ,则单体是_______ 和_____。
,则单体是_______ 和_____。
(5)I有多种同分异构体,其中一类同分异构体有如下特征:
①分子中含有五元环结构;②1mol该有机物与足量NaHCO3溶液反应,能生成1 molCO2;③1mol该有机物与足量Na反应,能生成1.5 mol H2;④环上的一氯代物只有三种。则满足以上条件的有机物的所有可能的结构简式为:_________________。
【答案】碳碳双键 CH3COOCH2CH3 C12H14O4 酯化反应 2 C2H5OH+O2 ![]() 2CH3CHO +2H2O 2CH3COOH+HO-CH2CH2-OH
2CH3CHO +2H2O 2CH3COOH+HO-CH2CH2-OH ![]() CH3COOCH2CH2OOCCH3+2H2O CH2=CH2 CH2=CH-CH3
CH3COOCH2CH2OOCCH3+2H2O CH2=CH2 CH2=CH-CH3 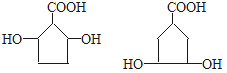
【解析】
据相对分子质量和用途确定气态烃A为乙烯,再由流程图依次确定B、C、D、E的结构简式。分别由“已知”I、II确定F为对苯二甲酸、H为乙二醇,进而确定G、I结构简式。
气态烃A与H2的相对密度为14,则Mr(A)=14×2=28,其产量可以用来衡量一个国家的石油化工发展水平,则A为乙烯(CH2=CH2),乙烯与水发生加成反应生成B为乙醇(CH3CH2OH),乙醇发生催化氧化生成C为乙醛(CH3CHO),C进一步发生氧化反应生成D为乙酸(CH3COOH),乙酸与乙醇发生酯化反应生成E为乙酸乙酯(CH3COOCH2CH3)。
芳香族化合物F为C、H、O化合物,1mol F与足量NaHCO3溶液反应能生成2mol CO2,则F分子中含有2个羧基(-COOH);F相对分子质量为166,2个羧基、1个-C6H4-的总式量为45×2+(12×6+4)=166,则F含有1个苯环、2个羧基;又苯环上的一氯代物只有一种,则F为![]() ,F与足量的B发生酯化反应生成G为
,F与足量的B发生酯化反应生成G为![]() 。
。
H为二元醇,其相对分子质量为22.4×2.77=62,去掉2个羟基(-OH),剩余基团式量为62-17×2=28,故为-C2H4-,则H为HOCH2CH2OH,H与足量D反应生成I为![]() 。
。
据此解答如下:
(1)A为CH2=CH2,含有官能团为碳碳双键,E的结构简式为CH3COOCH2CH3;
(2)G为![]() ,其分子式为C12H14O4,反应⑤是羧酸与醇发生的酯化反应,也属于取代反应;
,其分子式为C12H14O4,反应⑤是羧酸与醇发生的酯化反应,也属于取代反应;
(3)反应②的化学方程式为2CH3CH2OH+O2![]() 2CH3CHO+2H2O;
2CH3CHO+2H2O;
反应⑥的化学方程式为2CH3COOH+HOCH2CH2OH![]() CH3COOCH2CH2OOCCH3+2H2O,
CH3COOCH2CH2OOCCH3+2H2O,
(4)高分子化合物![]() 的主链上只有碳原子,为加聚反应的产物,其单体有两种:CH2=CH2、CH2=CH-CH3;
的主链上只有碳原子,为加聚反应的产物,其单体有两种:CH2=CH2、CH2=CH-CH3;
(5)I(![]() )及其同分异构体的分子式为C6H10O4,
)及其同分异构体的分子式为C6H10O4,
②1mol该有机物与足量NaHCO3溶液反应生成1mol CO2,则分子中含有1个羧基(-COOH);
③1mol该有机物与足量Na反应生成1.5mol H2,结合②可知,分子中还含有2个羟基(-OH);
结合分子式,①分子中含有的五元环结构只能是五元碳环;
④环上的一氯代物只有三种,则2个羟基(-OH)处于对称位置。
满足以上条件的有机物的所有可能的结构简式为: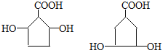 。
。