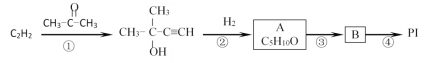
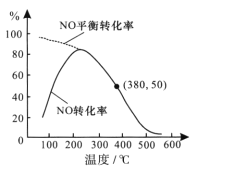
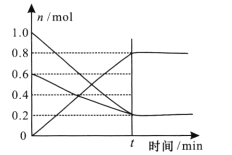
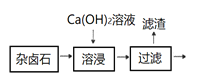
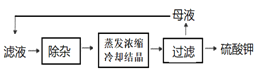
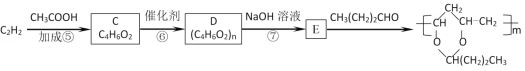题目内容
【题目】将4mol甲烷与氯气发生取代反应,待反应完全后甲烷与氯气均无剩余,测知四种取代物物质的量相同,则消耗的氯气( )
A. 2molB. 10molC. 7.5molD. 16 mol
【答案】B
【解析】
甲烷与氯气混合光照发生取代反应,甲烷中的氢原子逐步被取代生成一氯甲烷、二氯甲烷、三氯甲烷、四氯甲烷,据此计算消耗氯气的物质的量。
4mol甲烷与氯气反应生成四种取代物的物质的量相同,即各1mol。化学方程式如下:
①CH4+Cl2![]() CH3Cl+HCl
CH3Cl+HCl
②CH4+2Cl2![]() CH2Cl2+2HCl
CH2Cl2+2HCl
③CH4+3Cl2![]() CHCl3+3HCl
CHCl3+3HCl
④CH4+4Cl2![]() CCl4+4HCl,则共消耗1mol+2mol+3mol+4mol=10molCl2。
CCl4+4HCl,则共消耗1mol+2mol+3mol+4mol=10molCl2。
本题选B。

练习册系列答案
 发散思维新课堂系列答案
发散思维新课堂系列答案
相关题目