题目内容
1.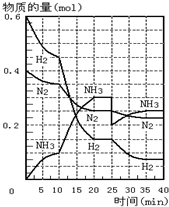 500℃、20MPa时,将H2和N2置于一容积为2L的密闭容器中发生反应.反应过程中H2、N2和NH3物质的量变化如图所示.则下列说法正确的是( )
500℃、20MPa时,将H2和N2置于一容积为2L的密闭容器中发生反应.反应过程中H2、N2和NH3物质的量变化如图所示.则下列说法正确的是( )①反应开始到第一次平衡时,N2的平均反应速率为0.005mol•L-1•min-1
②从曲线变化可以看出,反应进行到10min至20min钟时可能是使用了催化剂
③从曲线变化可以看出,反应进行至25min钟时,分离出0.1mol的氨气
④在25min时平衡正向移动但达到新平衡后NH3的体积分数比原平衡小.
| A. | ①②③ | B. | ②③④ | C. | ①②④ | D. | ①③④ |
分析 ①第一次平衡时,时间为20min,氮气的物质的量由0.4mol变为0.25mol,由于是恒压条件下,根据物质的量之比等于体积之比可知,此时容器体积为1.4L,此时氮气的浓度为0.179mol/L,根据速率公式可计算出氮气的速率;
②根据图象知,平衡向正反应方向移动,10min时是连续的,三种气体物质的速率增加倍数相同,说明为使用催化剂;
③25分钟,NH3的物质的量突然减少,而H2、N2的物质的量不变,说明应是分离出NH3;
④第25分钟,NH3的物质的量突然减少,而H2、N2的物质的量不变,说明应是分离出NH3,根据浓度对平衡影响分析.
解答 解:①第一次平衡时,时间为20min,氮气的物质的量由0.4mol变为0.25mol,由于是恒压条件下,根据物质的量之比等于体积之比可知,此时容器体积为1.4L,此时氮气的浓度为0.179mol/L,所以氮气的溶液变化为0.2mol/L-0.179 mol/L=0.121mol/L,v(N2)=$\frac{0.121mol/L}{20min}$=0.00605mol/(L•min),故错误;
②由图象可知各组分物质的量变化增加,且10min时变化是连续的,20min达平衡时,△n(N2)=0.4-0.25=0.15mol,△n(H2)=0.6mol-0.15mol=0.45mol,△n(NH3)=0.3mol,物质的量变化之比等于化学计量数之比,三种气体物质的速率增加倍数相同,说明10min可能改变的条件是使用催化剂,故正确;
③25分钟,NH3的物质的量突然减少,而H2、N2的物质的量不变,说明应是分离出NH3,故正确;
④第25分钟,NH3的物质的量突然减少,而H2、N2的物质的量不变,说明应是分离出NH3,平衡向正反应方向移动,由于反应条件为恒容,与原平衡相比,容器内压强减小,则反应进行的程度减小,但达到新平衡后NH3的体积分数比原平衡小,故正确;
故选B.
点评 本题考查化学平衡的计算、平衡移动以及平衡状态的判断,题目难度中等,注意对图象的分析.

 阅读快车系列答案
阅读快车系列答案| A. | 冰和干冰都是化合物 | B. | 纯碱是碱 | ||
| C. | K2SO4和K2CO3均属于钾盐 | D. | 豆浆是胶体 |
| A. | ③①④②⑤ | B. | ①③④②⑤ | C. | ③②①④⑤ | D. | ⑤②④①③ |
| A. | 反应过程中,若增大压强能提高SiCl4的转化率 | |
| B. | 若反应开始时SiCl4为1mol,则达平衡时,吸收热量为QkJ | |
| C. | 在温度、体积不变的情况下,若按照起始充入比例再向容器中充入反应物,重新达平衡后,HCl的体积分数不变 | |
| D. | 当反应吸收热量为0.025QkJ时,生成的HCl通入100mL 1mol/L的NaOH溶液恰好反应 |
| A. | 加入水时,溶液中c(H+) 和c(OH-) 都减小 | |
| B. | 加入少量NaOH固体,平衡向正反应方向移动 | |
| C. | 加入少量0.1mol/L HCl溶液,溶液中c(H+)减小 | |
| D. | 加入少量CH3COONa固体,平衡向正反应方向移动 |
| A. | $\frac{4}{5}$v (NH3)=v (O2) | B. | $\frac{5}{6}$v (O2)=v (H2O) | C. | $\frac{3}{2}$v (NH3)=v (H2O) | D. | $\frac{5}{4}$v (O2)=v (NO) |
| A. | 丁达尔效应可以用于区别FeCl3溶液和Fe(OH)3胶体 | |
| B. | 过滤和蒸发操作均用到玻璃棒,但玻璃棒的作用不相同 | |
| C. | 加入盐酸,能产生使澄清石灰水变浑浊的气体,则溶液中一定含有CO32- | |
| D. | 氨气能使湿润的红色石蕊试纸变蓝,说明氨气的水溶液呈碱性 |
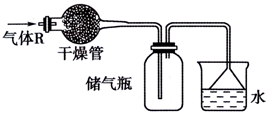 实验室里可按如图所示的装置干燥、储存气体R,多余的气体可用水吸收,则R是( )
实验室里可按如图所示的装置干燥、储存气体R,多余的气体可用水吸收,则R是( )| A. | NO | B. | HCl | C. | O2 | D. | NH3 |