题目内容
9.工业上制备纯硅反应的热化学方程式如下:SiCl4(g)+2H2(g)?Si(s)+4HCl(g);△H=+QkJ/mol(Q>0)某温度、压强下,将一定量反应物通入密闭容器进行以上反应(此条件下为可逆反应),下列叙述正确的是( )| A. | 反应过程中,若增大压强能提高SiCl4的转化率 | |
| B. | 若反应开始时SiCl4为1mol,则达平衡时,吸收热量为QkJ | |
| C. | 在温度、体积不变的情况下,若按照起始充入比例再向容器中充入反应物,重新达平衡后,HCl的体积分数不变 | |
| D. | 当反应吸收热量为0.025QkJ时,生成的HCl通入100mL 1mol/L的NaOH溶液恰好反应 |
分析 A.增大压强,平衡逆向移动;
B.根据可逆反应的特点判断;
C.在温度、体积不变的情况下,若按照起始充入比例再向容器中充入反应物,相当于增大压强;
D.根据方程式判断.
解答 解:A.该反应正向为气体物质体积减小的反应,若增大压强,平衡逆向移动,SiCl4的转化率减小,故A错误;
B.可逆反应的特点是不能进行到底,若反应开始时SiCl4为1 mol,则在平衡时,吸收热量小于QkJ,故B错误;
C.在温度、体积不变的情况下,若按照起始充入比例再向容器中充入反应物,相当于增大压强,平衡逆向移动,所以HCl的体积分数减小,故C错误;
D.根据题给热化学方程式知,当反应吸收热量为0.25QkJ时,生成的HCl为1mol,恰好与1 molNaOH反应,故D正确.
故选D.
点评 本题考查化学平衡的移动因素,为高频考点,侧重于学生的分析能力的考查,注意把握平衡移动的影响因素,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
19.常温下,下列各组离子在溶液中一定能大量共存的是( )
| A. | 1.0mol/L的KNO3溶液:H+、Fe2+、Cl-、SO42- | |
| B. | 与铝反应产生大量氢气的溶液:Na+、K+、HCO3-、NO3- | |
| C. | pH=12的溶液:K+、Na+、CH3COO-、Br- | |
| D. | 由水电离产生的c(H+)=10-13mol/L的溶液:NH4+、Ba2+、AlO2-、Cl- |
20.下列食物中属于酸性食物的是( )
| A. | 西红柿 | B. | 牛肉 | C. | 蜜橘 | D. | 黄瓜 |
4.300mL Al2(SO4)3溶液中,含Al3+为1.62g,在该溶液中加入0.1mol•L-1 Ba(OH)2溶液100mL,反应后溶液中SO42-的物质的量浓度约为( )
| A. | 0.4 mol•L-1 | B. | 0.3 mol•L-1 | C. | 0.2 mol•L-1 | D. | 0.1 mol•L-1 |
14.下列离子方程式正确的是( )
| A. | Fe粉加入稀盐酸中:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 金属钠投到水中:Na+H2O═Na++OH-+H2↑ | |
| C. | 石灰石投入到稀盐酸中:CO32-+2H+═CO2↑+H2O | |
| D. | 氢氧化钠溶液加入到稀硫酸中:OH-+H+═H2O |
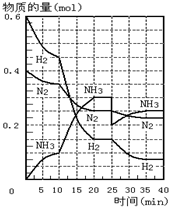 500℃、20MPa时,将H2和N2置于一容积为2L的密闭容器中发生反应.反应过程中H2、N2和NH3物质的量变化如图所示.则下列说法正确的是( )
500℃、20MPa时,将H2和N2置于一容积为2L的密闭容器中发生反应.反应过程中H2、N2和NH3物质的量变化如图所示.则下列说法正确的是( ) .
.