题目内容
16.0.1mol/L CH3COOH溶液中存在如下电离平衡:CH3COOH?CH3COO-+H+.对于该平衡,下列叙述正确的是( )| A. | 加入水时,溶液中c(H+) 和c(OH-) 都减小 | |
| B. | 加入少量NaOH固体,平衡向正反应方向移动 | |
| C. | 加入少量0.1mol/L HCl溶液,溶液中c(H+)减小 | |
| D. | 加入少量CH3COONa固体,平衡向正反应方向移动 |
分析 A、醋酸溶液中存在电离平衡,加入水促进电离,显性离子浓度减小,隐性离子浓度增大;
B、加入少量的氢氧化钠固体,消耗氢离子,氢离子浓度减小,平衡向正反应方向移动;
C、加入少量0.1mol/L HCl溶液,提供氢离子,氢离子浓度变大,平衡逆向移动,但根据平衡移动的原理,移动的结果是减弱,而不是抵消,所以溶液中c(H+)增大;
D、醋酸钠溶解后醋酸根离子抑制醋酸的电离.
解答 解:A、醋酸溶液中存在电离平衡,加入水促进电离,显性离子氢离子浓度减小,隐性离子氢氧根离子浓度增大,故A错误;
B、加入少量的氢氧化钠固体,消耗氢离子,氢离子浓度减小,平衡向正反应方向移动,故B正确;
C、加入少量0.1mol/L HCl溶液,提供氢离子,氢离子浓度变大,平衡逆向移动,但根据平衡移动的原理,移动的结果是减弱,而不是抵消,所以溶液中c(H+)增大,而不是减小,故C错误;
D、加入少量CH3COONa固体,溶解后醋酸根离子抑制醋酸电离,平衡向逆反应方向移动,故D错误;
故选B.
点评 本题考查了弱电解质电离平衡的影响因素分析和平衡移动方向的判断,要注意酸碱盐的影响分析是解题关键,比较容易.

练习册系列答案
相关题目
6. 有专家指出,如果燃烧产物如CO2、H2O、N2等利用太阳能使它们重新组合能够实现,那么,这不仅可以消除对大气的污染,还可以节约燃料,缓解能源危机.在此构想的物质循环中太阳能最终转化为( )
有专家指出,如果燃烧产物如CO2、H2O、N2等利用太阳能使它们重新组合能够实现,那么,这不仅可以消除对大气的污染,还可以节约燃料,缓解能源危机.在此构想的物质循环中太阳能最终转化为( )
 有专家指出,如果燃烧产物如CO2、H2O、N2等利用太阳能使它们重新组合能够实现,那么,这不仅可以消除对大气的污染,还可以节约燃料,缓解能源危机.在此构想的物质循环中太阳能最终转化为( )
有专家指出,如果燃烧产物如CO2、H2O、N2等利用太阳能使它们重新组合能够实现,那么,这不仅可以消除对大气的污染,还可以节约燃料,缓解能源危机.在此构想的物质循环中太阳能最终转化为( )| A. | 化学能 | B. | 热能 | C. | 生物能 | D. | 电能 |
4.300mL Al2(SO4)3溶液中,含Al3+为1.62g,在该溶液中加入0.1mol•L-1 Ba(OH)2溶液100mL,反应后溶液中SO42-的物质的量浓度约为( )
| A. | 0.4 mol•L-1 | B. | 0.3 mol•L-1 | C. | 0.2 mol•L-1 | D. | 0.1 mol•L-1 |
11.对于平衡体系mA(气)+nB(气)?PC(气)十qD(气)△H<0,有下列判断,其中正确的是( )
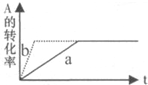

| A. | 若温度不变,将容器的体积缩小1倍,此时A的浓度变为原来的1.8倍,则m+n<p+q | |
| B. | 若平衡时,A、B的转化率相等,说明反应开始时A,B的物质的量之比为m:n | |
| C. | 若平衡体系共有气体amol,再向其中加人bmolB,当重新达到平衡时,气体的总物质的量等于(a+b),则m+n>p+q | |
| D. | 加催化剂或增大压强,可实现如图a→b的变化 |
8.下列溶液中,c(Cl-)最小的是( )
| A. | 20 mL 0.5 mol/L AlCl3溶液 | B. | 30 mL 1 mol/L KCl溶液 | ||
| C. | 7.5 mL 2 mol/L MgCl2溶液 | D. | 10 mL 3 mol/L NaCl溶液 |
5.浊液区别于其他分散系最本质的特征是( )
| A. | 外观浑浊不清 | B. | 浊液没有丁达尔现象 | ||
| C. | 不稳定 | D. | 分散质粒子直径大于1ⅹ10-7m |
5.下列关于中和热测定实验的说法中正确的是( )
| A. | 利用该实验的装置可以测定BaSO4的生成热 | |
| B. | 测定强酸强碱的中和热实验需要使用的玻璃仪器有:2 个500mL的烧杯、2个50mL的量筒、温度计 | |
| C. | 若将盐酸改用浓度和体积对应相同的CH3COOH进行实验,测得的△H将会减小 | |
| D. | 中和热测定实验中至少要测定3次温度 |
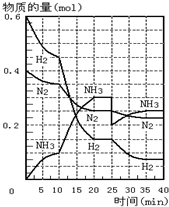 500℃、20MPa时,将H2和N2置于一容积为2L的密闭容器中发生反应.反应过程中H2、N2和NH3物质的量变化如图所示.则下列说法正确的是( )
500℃、20MPa时,将H2和N2置于一容积为2L的密闭容器中发生反应.反应过程中H2、N2和NH3物质的量变化如图所示.则下列说法正确的是( )