题目内容
向下列过量的酸中分别投入3.2g的铜,在相同条件下,反应后产生气体体积最大的是
| A.浓硫酸 | B.稀硫酸 | C.浓硝酸 | D.稀硝酸 |
C
3.2g的铜的物质的量是n=m/M=3.2/64=0.05mol
相同条件下气体的体积看物质的量即可。
A.Cu+2H2SO4(浓)=△=CuSO4+SO2↑+2H2O
1 1
0.05mol n
n=0.05mol
B. 稀硫酸与Cu不反应,不产生气体。
C.Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
1 2
0.05mol n
n=0.1mol
D. 3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
1 2
0.05mol n
n=0.033mol
所以产生气体体积的多少顺序是C>A>D>B,故选C。

练习册系列答案
相关题目
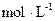 ,则c(H2)= ,20min内,用N2浓度的变化表示的反应速率为 。
,则c(H2)= ,20min内,用N2浓度的变化表示的反应速率为 。 )∶n(NH3)=1∶3∶2
)∶n(NH3)=1∶3∶2 SO4+2NH3+CO2+H2O= CaCO3+(NH4)2SO4
SO4+2NH3+CO2+H2O= CaCO3+(NH4)2SO4
 (1)维生素C又称抗坏血酸,其水溶液显酸性。向维生素C的溶液中滴加紫色石蕊溶液,溶液变 色。
(1)维生素C又称抗坏血酸,其水溶液显酸性。向维生素C的溶液中滴加紫色石蕊溶液,溶液变 色。 ② KI溶液 ③酸性KMnO4溶液
② KI溶液 ③酸性KMnO4溶液 ② KI ③ KIO3
② KI ③ KIO3