��Ŀ����
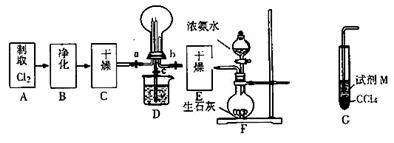
(12)������Ҫ��������ԭ�ϣ�Ҳ�Ǻϳɵ��ʵ���Ҫԭ�ϣ���˺ϳɰ��ڹ�����ռ����Ҫ��λ��
�Ź�ҵ�ϳɰ���Ӧ�Ļ�ѧ����ʽΪ ��
�ƺ����£���һ��2L���ܱ������г���1mol N2��2.6mol H2��20minʱ����Ӧ�ﵽƽ�⣬������c(NH3)Ϊ0.08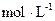 ����c(H2)= ��20min�ڣ���N2Ũ�ȵı仯��ʾ�ķ�Ӧ����Ϊ ��
����c(H2)= ��20min�ڣ���N2Ũ�ȵı仯��ʾ�ķ�Ӧ����Ϊ ��
��ij�¶��£���һ��2L���ܱ������г���1mol N2��3mol H2���ں����·�Ӧ��������˵����Ӧ�ﵽƽ��״̬����
�ٵ�λʱ��������0.1molN2��ͬʱ����0.2molNH3
�ڵ�λʱ��������0.3molH2��ͬʱ����0.2molNH3
��n(N2)��n(H2 )��n(NH3)=1��3��2
)��n(NH3)=1��3��2
��c(NH3)=0.08mol/L
��������ѹǿ����
�ȹ�ҵ��Լ��80%�İ��������컯�ʡ�ij���ʳ������̬����(NH4)2SO4�ķ�Ӧ�ɱ�ʾΪ��Ca SO4+2NH3+CO2+H2O= CaCO3+(NH4)2SO4
SO4+2NH3+CO2+H2O= CaCO3+(NH4)2SO4
�ٷ�Ӧǰ�Ƚ�CaSO4ĥ�ɷ�ĩ������ˮ���Ƴ�����Һ�������÷�ɢϵ�з�ɢ������ֱ�� 10��7m���������������
����CaSO4����Һ��ͨ������ʱ������ͨ������NH3��ͨ��CO2��ԭ���� ��
�Ź�ҵ�ϳɰ���Ӧ�Ļ�ѧ����ʽΪ ��
�ƺ����£���һ��2L���ܱ������г���1mol N2��2.6mol H2��20minʱ����Ӧ�ﵽƽ�⣬������c(NH3)Ϊ0.08
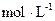 ����c(H2)= ��20min�ڣ���N2Ũ�ȵı仯��ʾ�ķ�Ӧ����Ϊ ��
����c(H2)= ��20min�ڣ���N2Ũ�ȵı仯��ʾ�ķ�Ӧ����Ϊ ����ij�¶��£���һ��2L���ܱ������г���1mol N2��3mol H2���ں����·�Ӧ��������˵����Ӧ�ﵽƽ��״̬����
�ٵ�λʱ��������0.1molN2��ͬʱ����0.2molNH3
�ڵ�λʱ��������0.3molH2��ͬʱ����0.2molNH3
��n(N2)��n(H2
 )��n(NH3)=1��3��2
)��n(NH3)=1��3��2��c(NH3)=0.08mol/L
��������ѹǿ����
�ȹ�ҵ��Լ��80%�İ��������컯�ʡ�ij���ʳ������̬����(NH4)2SO4�ķ�Ӧ�ɱ�ʾΪ��Ca
 SO4+2NH3+CO2+H2O= CaCO3+(NH4)2SO4
SO4+2NH3+CO2+H2O= CaCO3+(NH4)2SO4�ٷ�Ӧǰ�Ƚ�CaSO4ĥ�ɷ�ĩ������ˮ���Ƴ�����Һ�������÷�ɢϵ�з�ɢ������ֱ�� 10��7m���������������
����CaSO4����Һ��ͨ������ʱ������ͨ������NH3��ͨ��CO2��ԭ���� ��
(12�֣��ڢ���3�֣��ڢȢ���1�֣�����ÿ��2��)
��N2+3H2 2NH3 ��1.18
2NH3 ��1.18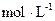 0.002
0.002 �Ǣڢ�
�Ǣڢ�
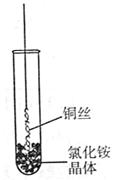
�Ȣ٣� �ڰ�����������ˮ��ͨ����������ʹ��Һ�ʼ��ԣ�����������CO2������c( )����ʹCaSO4ת��ΪCaCO3�����Ƶ�(NH4)2SO4��
)����ʹCaSO4ת��ΪCaCO3�����Ƶ�(NH4)2SO4��
��N2+3H2
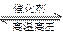 2NH3 ��1.18
2NH3 ��1.18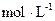 0.002
0.002 �Ǣڢ�
�Ǣڢ��Ȣ٣� �ڰ�����������ˮ��ͨ����������ʹ��Һ�ʼ��ԣ�����������CO2������c(
 )����ʹCaSO4ת��ΪCaCO3�����Ƶ�(NH4)2SO4��
)����ʹCaSO4ת��ΪCaCO3�����Ƶ�(NH4)2SO4����

��ϰ��ϵ�д�
 �������Ͽ�ʱͬ��ѵ��ϵ�д�
�������Ͽ�ʱͬ��ѵ��ϵ�д� �������ͬ����ϰϵ�д�
�������ͬ����ϰϵ�д�
�����Ŀ
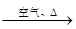 CuO
CuO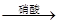 Cu(NO3)2
Cu(NO3)2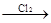 CuCl2
CuCl2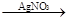 Cu(NO3)2
Cu(NO3)2