题目内容
【题目】X、Y、Z、W、Q、E、R是7种短周期元素。已知X、Y、Z、W在周期表中相对位置如图所示,且W原子最外层电子数是其内层电子数的![]() ,Q元素组成的单质是最理想的气体燃料,E的原子最外层电子数是次外层电子数的3倍,R的单质通常用于自来水的消毒。
,Q元素组成的单质是最理想的气体燃料,E的原子最外层电子数是次外层电子数的3倍,R的单质通常用于自来水的消毒。
![]()
请回答下列问题:
(1)E在周期表中的位置是______;R的单质与镁形成的化合物电子式为____。
(2)由X和Q组成的一种气体,其密度与相同条件下的Y单质密度相同,则该气体使溴水褪色的化学方程式为__________;该反应类型为_______。
(3)关于以上元素说法正确的是_______(填字母)。
a.Y的最简单氢化物分解比Z的难
b.X元素是自然界中能形成化合物种类最多的元素,是因为X在自然界含量最丰富
c.R的单质通常用于自来水的消毒是因为该单质有毒性,可以“以毒攻毒”
d.Z的一种单质可用于制火柴
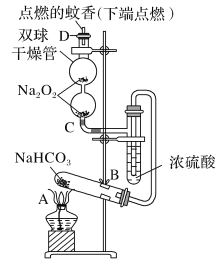
(4)可利用如图装置(烧瓶B下面的加热装置未画出)验证元素非金属性的强弱关系。
现用药品Na2S溶液、浓盐酸、MnO2来设计实验验证R的非金属性强于W,则:实验中能够说明R的非金属性强于W的主要现象是__________;B中反应离子方程式为________。
【答案】第二周期第VIA族 ![]() CH2=CH2 + Br2 → CH2BrCH2Br 加成反应 ad 装置C中有淡黄色沉淀生成 MnO2+4H++2Cl-
CH2=CH2 + Br2 → CH2BrCH2Br 加成反应 ad 装置C中有淡黄色沉淀生成 MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
【解析】
X、Y、Z、W、Q、E、R是7种短周期元素。W原子最外层电子数是其内层电子数的![]() ,则其核外电子排布为2、8、6,W为硫(S);由此可确定X为碳(C)、Y为氮(N)、Z为磷(P);Q元素组成的单质是最理想的气体燃料,则Q为氢(H);E的原子最外层电子数是次外层电子数的3倍,则E为氧(O);R的单质通常用于自来水的消毒,则R为氯(Cl)。
,则其核外电子排布为2、8、6,W为硫(S);由此可确定X为碳(C)、Y为氮(N)、Z为磷(P);Q元素组成的单质是最理想的气体燃料,则Q为氢(H);E的原子最外层电子数是次外层电子数的3倍,则E为氧(O);R的单质通常用于自来水的消毒,则R为氯(Cl)。
由以上分析可知,X、Y、Z、W、Q、E、R分别为C、N、P、S、H、O、Cl。
(1)E为氧,核外电子排布为2、6,则其在周期表中的位置是第二周期第VIA族;R为氯(Cl),它的单质与镁形成MgCl2,电子式为![]() 。答案为:第二周期第VIA族;
。答案为:第二周期第VIA族;![]() ;
;
(2)由C和H组成的一种气体,其密度与相同条件下的N2密度相同,则相对分子质量为28,其为乙烯,乙烯使溴水褪色的化学方程式为CH2=CH2 + Br2 → CH2BrCH2Br;该反应为加成反应。答案为:CH2=CH2 + Br2 → CH2BrCH2Br;加成反应;
(3)a.因为非金属性N>P,所以氢化物的稳定性NH3>PH3,a正确;
b.碳元素形成化合物种类最多,是因为碳呈四价且碳原子间能形成单键、双键、三键等,b不正确;
c.氯的单质通常用于自来水的消毒,是因为其与水反应生成HClO,具有杀菌消毒能力,c不正确;
d.磷的一种单质红磷可用于制安全火柴,d正确;
故选ad。答案为:ad;
(4)从图中可知,B中放入MnO2,与A中的浓盐酸在加热条件下反应生成Cl2,Cl2与Na2S发生置换反应生成S和NaCl,则实验中能够说明Cl的非金属性强于S的主要现象是装置C中有淡黄色沉淀生成;B中反应离子方程式为MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O。答案为:装置C中有淡黄色沉淀生成;MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O。答案为:装置C中有淡黄色沉淀生成;MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O。
Mn2++Cl2↑+2H2O。