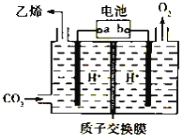
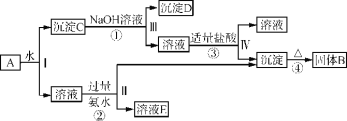
题目内容
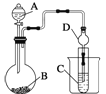
【题目】如图所示原电池装置中,电解质溶液为硫酸,下列有关叙述错误的是
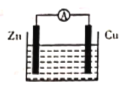
A. 锌做负极发生氧化反应
B. 供电时的总反应为Zn+2H+=Zn2++H2↑
C. 该装置可实现化学能转化为电能
D. 正极产生1 mol H2,消耗锌的质量为32.5 g
【答案】D
【解析】
锌比铜活泼,锌为负极,发生氧化反应,铜为正极,发生还原反应,以此解答该题。
A.锌为负极,Zn失电子发生氧化反应,故A正确;
B.原电池工作时总反应为:Zn+2H+=Zn2++H2↑,故B正确;
C.该装置为原电池,原电池是化学能转化为电能的装置,故C正确;
D.原电池工作时总反应为:Zn+2H+=Zn2++H2↑,产生1molH2,消耗锌的质量为65g,故D错误;
故答案选D。

练习册系列答案
 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案
相关题目
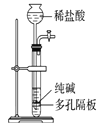
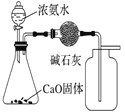
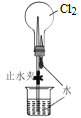
【题目】下列有关实验装置进行的相应实验,能达到实验目的的是( )
选项 | A | B | C | D |
实验 装置 |
|
|
|
|
实验 目的 | 制取少量纯净的CO2气体 | 验证钠和水的反应是放热反应 | 制取并收集干燥纯净的NH3 | 进行喷泉实验 |
A.AB.BC.CD.D