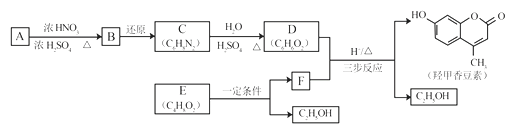
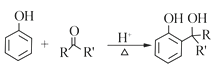
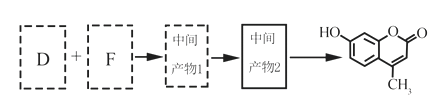
题目内容
【题目】在容积为1L的密闭容器中,通入一定量的N2O4,发生反应N2O4(g)![]() 2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
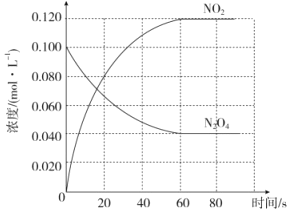
(1)反应的△H______0(填“大于”“小于”);100℃时,体系中各物质浓度随时间变化如图所示。在0~60s时段,反应速率v(N2O4)为________molL-1s-1
(2)100℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020molL-1s-1的平均速率降低,10s又达到平衡。T_______100℃(填“大于”“小于”)。
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向_______(填“正反应”或“逆反应”)方向移动
(4)再次到达平衡后,向容器中加入合适的正催化剂,则v正_______v逆_______,(填“增大”、“减小”或“不变”),体系的颜色_______(填“变深” “变浅”或“不变”)。
【答案】大于 0.001 大于 逆反应 增大 增大 不变
【解析】
(1)反应N2O4(g)![]() 2NO2(g),随温度升高,混合气体的颜色变深,说明升温平衡向正反应方向移动;
2NO2(g),随温度升高,混合气体的颜色变深,说明升温平衡向正反应方向移动;
(2)100℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020molL-1s-1的平均速率降低,说明改变反应温度为T时,平衡向正反应方向移动;
(3)将反应容器的容积减少一半,即为增大压强;
(4) 正催化剂同等程度增大正逆反应速率,但是平衡不移动;
(1)由分析可知,升温平衡向正反应方向移动,即正反应方向是吸热反应,△H大于0;由图可知,在0~60s时段,△c(N2O4)= 0.06 molL-1,v(N2O4)=![]() =0.001molL-1s-1;
=0.001molL-1s-1;
(2)由分析可知,改变反应温度为T时,平衡向正反应方向移动,该反应△H大于0,则温度T大于100℃;
(3) 该反应正反应方向气体数目增大,增大压强,平衡向气体数目减小的方向移动,即平衡向逆反应方向移动;
(4) 由分析可知,加入合适的正催化剂,正逆反应速率均增大,但是平衡不移动,所以体系的颜色不变。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案