题目内容
【题目】乙酸乙酯是一种有水果香味的油状液体,实验室通常用乙酸与乙醇在浓硫酸存在并加热的条件下反应生成乙酸乙酯。请回答:
(1)工业上常用乙烯水化法制备乙醇,乙烯的结构简式为____________。
(2)制备乙酸乙酯的化学方程式为__________________________,该反应的类型是_______反应。
(3)乙醇俗称酒精,是一种重要无污染的燃料和化工原料,乙醇的官能团为__________(写名称)。
【答案】CH2=CH2 CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O 酯化反应(或取代反应) 羟基
CH3COOCH2CH3+H2O 酯化反应(或取代反应) 羟基
【解析】
(1)书写有机物的结构简式时,要把碳氢单键省略,但需要表现该物质中的官能团,乙烯分子中含有碳碳双键,其结构简式为CH2=CH2,故答案为:CH2=CH2;
(2)根据题干信息,实验室用乙酸与乙醇在浓硫酸存在并加热的条件下发生酯化反应生成乙酸乙酯,酯化反应也是取代反应,该反应的化学反应方程式为:CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O,故答案为:CH3COOH+CH3CH2OH
CH3COOCH2CH3+H2O,故答案为:CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O;酯化反应(或取代反应);
CH3COOCH2CH3+H2O;酯化反应(或取代反应);
(3)乙醇的结构简式为CH3CH2OH,含有的官能团为—OH,名称为羟基,故答案为:羟基。

【题目】汽车内燃机燃烧时,在高温引发氮气和氧气反应会产生 NOx 气体,NOx 的消除是科研人员研究的重要课题。
(1)通过资料查得 N2(g)+O2(g)2NO(g)△H反应温度不平衡常数的关系如下表:
反应温度/℃ | 1538 | 2404 |
平衡常数 |
|
|
则△H___________________0(填“<”“>”戒“=”)
(2)在 800℃时,测得 2NO(g)+O2(g) 2NO2(g)的反应速率不反应物浓度的关系如下表所示
初始浓度/ | 初始速率/ | |
C0(NO) | C0(O2) | |
0.01 | 0.01 |
|
0.01 | 0.02 |
|
0.03 | 0.02 |
|
已知反应速率公式为 V 正=K 正×c m(NO)cn(O2),则 m=___________________, K 正=___________________L2mol-2s-1
(3)在某温度下(恒温),向体积可变的容器中充人 NO2 气体,发生反应 2NO2(g) N2O4(g),气体分压随时间的变化关系如图
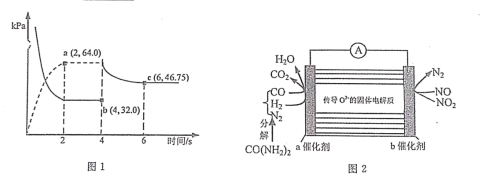
①该反应的压力平衡常数 KP=___________________。
②4s 时压缩活塞(活塞质量忽略不计)使容器体积变为原体积的 1/2,6s 时重新达到平衡,则P(N2O4)=___________________kPa。
(4)某学习小组利用图 2 装置探究向汽车尾气中喷入尿素溶液处理氮的氧化物。则该装置工作时,NO2 在 b 电极上的电极反应式为___________________。