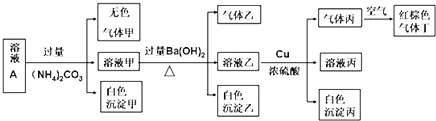
��Ŀ����
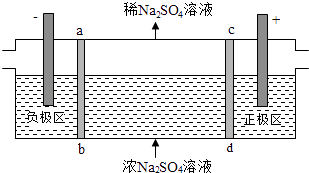
����Ŀ����ʽ��������NiOOH�������������ص��������ϣ��Ժ�����Ni2+����ҺΪԭ������NiOOH��һ�ֹ���������ͼ1�� 
��1������Na2CO3��Һʱ��֤��Ni2+�Ѿ���ȫ������ʵ�鷽���� �� ����ʱ���õ��IJ����������ձ���
��2��д��̼������ϡ���ᷴӦ�����ӷ���ʽ ��
��3����������Һ�������Ʊ��ϳɰ��Ĵ���ConNi��1��n��Fe2O4 �� ������������ͬʱ�ϳɰ�����Գ�ʼ�����������nֵ�仯��������ͼ����ͼ������֪Co2+��Ni2+���������д�Ч�����õ���
��4��д���ڿ����м���Ni��OH��2��ȡNiOOH�Ļ�ѧ����ʽ�� ��
��5�������Ȳ���֣����Ƶõ�NiOOH�л����Ni��OH��2 �� ����ɿɱ�ʾΪxNiOOHy Ni��OH��2 �� �ֳ�ȡ9.21g��Ʒ����ϡ�����У���ȴ��ת������ƿ�����Ƴ�500mL��Һ��ȡ��25.00mL����0.100mol/LKMnO4����Һ�ζ�����ȥKMnO4����Һ10.00mL����x��y= �� [��֪��Ӧ��δ��ƽ����Ni2++MnO4��+H+��Ni2++Mn2++H2O]��
���𰸡�
��1�����ã����ϲ���Һ�м����μ�1��2��Na2CO3��Һ���������ɣ�©����������
��2��NiCO3+2H+=Ni2++H2O+CO2��
��3��Co2+
��4��4Ni��OH��2+O2 ![]() 4NiOOH+2H2O
4NiOOH+2H2O
��5��9��1
���������⣺������Ni2+����ҺΪԭ������NiOOH���ں�Ni+�ķ�Һ���м���̼������Һ�����˵õ�NiCO3�����������м��������ܽ�����NiSO4 �� �����Լ�������Һ��pHʹ������ȫ����������Ni��OH��2 �� �ڿ����м���Ni��OH��2��ȡNiOOH����1��ȷ��Ni2+�Ѿ���ȫ������ʵ�鷽����ȡ�ϲ���Һ������̼������Һ�۲��Ƿ��г������ɣ��ж��������Ƿ�ȫ�������������������Ϊ�����ã����ϲ���Һ�м����μ�1��2��Na2CO3��Һ���������ɣ������õ��IJ����������ձ���©���������������Դ��ǣ����ã����ϲ���Һ�м����μ�1��2��Na2CO3��Һ���������ɣ�©��������������2��̼������ϡ���ᷴӦ������������������̼��ˮ����Ӧ�����ӷ���ʽΪNiCO3+2H+=Ni2++H2O+CO2����
���Դ��ǣ�NiCO3+2H+=Ni2++H2O+CO2������3����ͼ��֪����nֵԽ�ϳɰ�����Գ�ʼ����Խ��n����Co2+�ı�������Co2+�Ĵ����Ը��ߣ�
���Դ��ǣ�Co2+����4�������м���Ni��OH��2�Ϳ�����������Ӧ����NiOOH��ˮ��ԭ���غ���ƽ��д��ѧ����ʽΪ��4Ni��OH��2+O2 ![]() 4NiOOH+2H2O��
4NiOOH+2H2O��
���Դ��ǣ�4Ni��OH��2+O2 ![]() 4NiOOH+2H2O����5������KMnO4���ʵ�����0.01 molL��1��0.02L=2��10��4 mol
4NiOOH+2H2O����5������KMnO4���ʵ�����0.01 molL��1��0.02L=2��10��4 mol
��NiOOH��Ӧ��ʣ���Fe2+���ʵ�����2��10��4 mol��5����200��20��=0.01 mol
Fe2+�����ʵ�����1.0 molL��1��0.1 L=0.1 mol
��NiOOH��Ӧ��Fe2+�����ʵ�����0.1 mol��0.01 mol=0.09 mol
n��NiOOH��=0.09 mol
m��NiOOH��=91.7 gmol��1��0.09 mol=8.253 g
n[Ni��OH��2]= ![]() =0.01 mol
=0.01 mol
x��y=n��NiOOH����n[Ni��OH��2]=0.09 mol��0.01 mol=9��1��
���Դ��ǣ�9��1��

����Ŀ���������ȣ�ClO2���Ǹ�Ч��ȫ������ˮ���������õ�Խ��Խ�㷺��Ӧ�ã��ش��������⣺
��1��ʵ���Һϳ�ClO2���������˫��ˮ��ԭ�����ƣ�NaClO3����
�������NaClO3��Ӧʱ��ClO2��Cl2���ɣ���Ӧ�����ӷ���ʽΪ �� ����Ӧ��ת��0.2mol ����ʱ���μӷ�Ӧ�Ļ�ԭ�������ʵ���Ϊ ��
��ʹ��˫��ˮ����ԭ�����ŵ��� ��
��2��ClO2�����ںϳ��������ƣ�NaClO2������ClO2ͨ��NaOH��Һ�У�����������˫��ˮ�����ȶ�װ���г�ַ�Ӧ���Ƶ�NaClO2��Ʒ�� ��֪����pH��2.0ʱ��NaClO2�ܱ�I����ȫ��ԭ��Cl�����������ȣ�ClO2���Ǹ�Ч��ȫ������ˮ���������õ�Խ��Խ�㷺��Ӧ�ã��ش��������⣺
��Һ��Na2S2O3����I2��Ӧ����NaI��Na2S4O6 �� ���ⶨ��Ʒ��NaClO2�ĺ������ֽ������²�����
����� | ��ȡ��ƷWg�����Һ������ƿ�У�������PH��2.0 |
����� | ����ƿ�м�������KI���壬��ֽ��裬����������ָʾ�� |
����� | ��c mol/L��Na2S2O3��Һ�ζ� |
�ٲ���2������Ӧ�����ӷ���ʽΪ �� ����ָʾ���������� ��
���������ζ�������ƽ������VmL Na2S2O3����Һ�����Ʒ��NaClO2����������Ϊ���ú�w��c��V�Ĵ���ʽ��ʾ����
��3��ClO2��Cl2���ܽ���Ʒ�ˮ�е�CN������Ϊ�������ʣ���������ԭΪCl�� �� ��������ͬ��CN���ĵ�Ʒ�ˮ������Cl2�����ʵ�����ClO2������