题目内容
【题目】常温下,pH=1的某溶液A中含有NH4+、K+、Na+、Fe2+、Al3+、Fe3+、CO32﹣、NO3﹣、Cl﹣、I﹣、SO42﹣中的几种,且各离子浓度均为0.1mol/L,现取该溶液进行有关实验,实验结果如图所示: 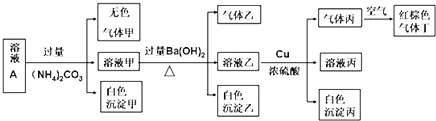
回答下列问题:
(1)溶液A中一定不存在的阴离子有 .
(2)生成沉淀甲和沉淀乙的离子方程式分别为 .
(3)气体乙的结构式为 .
(4)生成气体丙的离子方程式为若实验消耗Cu 144g,则最多生成气体丁的体积(标准状况下)为 .
【答案】
(1)CO32﹣
(2)2Al3++3CO32﹣+3H2O═2Al(OH)3↓+3CO2↑、Ba2++CO32﹣=BaCO3↓
(3)![]()
(4)3Cu+2NO3﹣+8H+=3Cu2++2NO↑+4H2O;33.6L
【解析】解:由溶液pH=1可知溶液为酸性溶液,溶液中存在大量氢离子,可以排除CO32﹣; 溶液A中加过量(NH4)2CO3 , 产生白色沉淀,白色沉淀只能为氢氧化铝,可以排除Fe2+、Fe3+ , 溶液含有一定有Al3+;
溶液乙加铜和浓硫酸能产生气体丙,丙在空气中变成红棕色,则丙为NO,原溶液中有NO3﹣ , 强酸性溶液中含有NO3﹣ , 则一定不存在具有还原性的离子:Fe2+、I﹣;最后根据电荷守恒得原溶液中含有H+、NO3﹣、Al3+、SO42﹣ Cl﹣五种离子.(1)通过以上分析知,溶液A中一定不存在的阴离子有CO32﹣ , 所以答案是:CO32﹣;(2)沉淀甲是铝离子和碳酸根离子的双水解反应生成氢氧化铝沉淀和二氧化碳,生成沉淀乙是钡离子和碳酸根离子的反应,二者离子方程式分别为2Al3++3CO32﹣+3H2O═2Al(OH)3↓+3CO2↑、Ba2++CO32﹣=BaCO3↓,
所以答案是:2Al3++3CO32﹣+3H2O═2Al(OH)3↓+3CO2↑、Ba2++CO32﹣=BaCO3↓;(3)铵根离子和氢氧根离子反应生成氨气,氨气分子中每个H原子和N原子之间共用一对电子,其结构式为 ![]() ,所以答案是:
,所以答案是: ![]() ;(4)酸性条件下,铜和硝酸根离子发生氧化还原反应生成铜离子和NO,离子方程式为3Cu+2NO3﹣+8H+=3Cu2++2NO↑+4H2O,根据转移电子守恒得V(NO)=
;(4)酸性条件下,铜和硝酸根离子发生氧化还原反应生成铜离子和NO,离子方程式为3Cu+2NO3﹣+8H+=3Cu2++2NO↑+4H2O,根据转移电子守恒得V(NO)= ![]() ×22.4L/mol=33.6L,
×22.4L/mol=33.6L,
所以答案是:3Cu+2NO3﹣+8H+=3Cu2++2NO↑+4H2O;33.6L.



