题目内容
6.某物质的水溶液能导电,且溶液中不存在溶质分子,但该物质属于非电解质,符合该条件的物质是( )| A. | Cl2 | B. | CO2 | C. | NO2 | D. | NaCl |
分析 物质的水溶液能导电,说明物质溶于水后有自由移动的离子产生;溶于中不存在溶质分子,说明此物质溶于水后要么完全和水反应,要么完全电离;非电解质是在水溶液中和熔融状态下均不能导电的化合物,据此分析.
解答 解:A、氯气是单质,既不是电解质也不是非电解质,故A错误;
B、二氧化碳在熔融状态下不能导电,在水溶液中导电和其本身无关,故二氧化碳为非电解质;二氧化碳溶于水后能和水反应生成H2CO3,而H2CO3是弱酸,不能完全电离,故溶于中存在溶质分子,故B错误;
C、二氧化氮在熔融状态下不能导电,在水溶液中导电和其本身无关,故二氧化氮为非电解质;NO2溶于水后和水反应生成HNO3,所得溶液能导电,但HNO3是强酸,完全电离为氢离子和硝酸根,故溶液中无溶质分子,故C正确;
D、氯化钠在水溶液中或熔融状态下能导电,故为电解质,故D错误.
故选C.
点评 本题考查了电解质和非电解质的概念以及溶液导电的判断,根据其定义来分析解答即可,难度不大.

练习册系列答案
相关题目
18.现有四种溶液:①0.01mol/L HCl溶液 ②PH=2的CH3COOH溶液 ③PH=12的NaOH溶液 ④0.01mol/LNH3•H2O溶液,下列有关四种溶液的说法中不正确的是( )
| A. | 水的电离程度:①=②=③<④ | B. | 与相同Zn粒反应平均速率:①<② | ||
| C. | 溶液PH值:①=②<③<④ | D. | 稀释相同的倍数所得溶液PH值:③>④ |
19.在恒温恒容体系中建立平衡aA(g)?bB(g)+cC(g),若再加入A.
2.在恒温恒容体系中建立平衡aA(g)+bB(g)?cC(g)+dD(g)
①若在相同的容器中只增加A的用量,平衡正向移动,A的转化率减小,B的转化率增大;若只减少A的用量,平衡逆向移动,A的转化率增大,B的转化率减小.
②按原投料比例的同倍数同时增大反应物A、B的用量,
若a+b=c+d,A的转化率不变,B的转化率不变.
若a+b>c+d,A的转化率增大,B的转化率增大.
若a+b<c+d,A的转化率减小,B的转化率减小.
| 平衡移动方向 | A的转化率 | 解释 | |
| a=b+c | |||
| a>b+c | |||
| a<b+c |
①若在相同的容器中只增加A的用量,平衡正向移动,A的转化率减小,B的转化率增大;若只减少A的用量,平衡逆向移动,A的转化率增大,B的转化率减小.
②按原投料比例的同倍数同时增大反应物A、B的用量,
若a+b=c+d,A的转化率不变,B的转化率不变.
若a+b>c+d,A的转化率增大,B的转化率增大.
若a+b<c+d,A的转化率减小,B的转化率减小.
18.下列装置或操作正确,且能达到目的是( )
| A. |  依据褪色快慢比较浓度对反应速率的影响 | |
| B. |  测定盐酸浓度 | |
| C. | 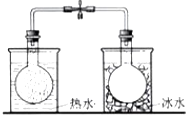 依据气体颜色变化,证明温度对平衡移动的影响 | |
| D. |  中和热的测定 |
16.下列鉴别方法不能达到实验目的是( )
| A. | 用激光笔鉴别淀粉溶液与葡萄糖溶液 | |
| B. | 用KOH溶液鉴别NH4Cl、AlCl3、MgSO4、FeCl3四种溶液 | |
| C. | 用盐酸溶液鉴别Na2CO3溶液和Na2SiO3溶液 | |
| D. | 用BaCl2溶液鉴别AgNO3和Na2SO4 |
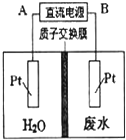 用如图所示装置处理含 NO${\;}_{3}^{-}$的酸性工业废水,某电极反应式为 2NO${\;}_{3}^{-}$+12H++10e-═N2↑+6H2O,请回答下列问题.
用如图所示装置处理含 NO${\;}_{3}^{-}$的酸性工业废水,某电极反应式为 2NO${\;}_{3}^{-}$+12H++10e-═N2↑+6H2O,请回答下列问题.