题目内容
19.在恒温恒容体系中建立平衡aA(g)?bB(g)+cC(g),若再加入A.| 平衡移动方向 | A的转化率 | 解释 | |
| a=b+c | |||
| a>b+c | |||
| a<b+c |
①若在相同的容器中只增加A的用量,平衡正向移动,A的转化率减小,B的转化率增大;若只减少A的用量,平衡逆向移动,A的转化率增大,B的转化率减小.
②按原投料比例的同倍数同时增大反应物A、B的用量,
若a+b=c+d,A的转化率不变,B的转化率不变.
若a+b>c+d,A的转化率增大,B的转化率增大.
若a+b<c+d,A的转化率减小,B的转化率减小.
分析 1、在恒温恒容体系中建立平衡aA(g)?bB(g)+cC(g),若再加入A相当于增大容器中的压强,压强增大平衡向气体体积减小的方向进行,据此分析平衡移动方向,物质A的转化率;
2、①若在相同的容器中只增加A的用量,是增大反应物浓度,平衡正向进行,两种反应物,增大一种会提高另一种的转化率,本身转化率减小,若减少反应物的量本身转化率增大,另一种转化率减小;
②按原投料比例的同倍数同时增大反应物A、B的用量,相当于增大容器内压强,结合反应前后气体体积变化和平衡移动原理分析平衡移动方向判断转化率变化;
解答 解:1、在恒温恒容体系中建立平衡aA(g)?bB(g)+cC(g),若再加入A相当于增大容器中的压强,压强增大平衡向气体体积减小的方向进行,据此分析平衡移动方向,物质A的转化率,
| 平衡移动方向 | A的转化率 | 解释 | |
| a=b+c | 平衡不动 | 不变 | 反应前后气体体积不变,增大压强平衡不变 |
| a>b+c | 平衡正向进行 | 增大 | 反应前后气体体积减小,增大压强平衡正向进行 |
| a<b+c | 平衡逆向进行 | 减小 | 反应前后气体体积增大,增大压强平衡逆向进行 |
| 平衡移动方向 | A的转化率 | 解释 | |
| a=b+c | 平衡不动 | 不变 | 反应前后气体体积不变,增大压强平衡不变 |
| a>b+c | 平衡正向进行 | 增大 | 反应前后气体体积减小,增大压强平衡正向进行 |
| a<b+c | 平衡逆向进行 | 减小 | 反应前后气体体积增大,增大压强平衡逆向进行 |
故答案为:正向,减小,增大,逆向,增大,减小;
②按原投料比例的同倍数同时增大反应物A、B的用量,相当于增大容器内压强,结合反应前后气体体积变化和平衡移动原理分析平衡移动方向判断转化率变化,
若a+b=c+d,反应前后气体体积不变,增大压强平衡不变,A的转化率不变,B的转化率不变.
若a+b>c+d,反应前后气体体积减小,增大压强平衡正向进行,A的转化率增大,B的转化率增大.
若a+b<c+d,反应前后气体体积增大,增大压强平衡逆向进行,A的转化率减小,B的转化率减小.
故答案为:不变,不变,增大,增大,减小,减小;
点评 本题考查了化学平衡的影响因素分析判断,主要是反应特征和平衡移动原理的理解应用,掌握基础是解题关键,题目难度中等.

练习册系列答案
相关题目
9.用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | Na2O2与CO2反应当产生0.1molO2时转移电子数为0.4NA | |
| B. | 10gNH4+中含有的电子数为NA | |
| C. | 11.2LO2和N2的混合气体含有的分子数为0.5NA | |
| D. | 25℃、101Pa时,16g O2和O3混合气体中含有的原子数为NA |
10.下列每组反应一定能用同一离子方程式表示的是( )
| A. | CuO分别与稀硫酸、稀盐酸反应 | |
| B. | CaCO3、Na2CO3分别与盐酸反应 | |
| C. | H2SO4、K2SO4溶液分别与Ba(OH)2溶液反应 | |
| D. | Na、Mg分别与稀盐酸反应 |
6.某物质的水溶液能导电,且溶液中不存在溶质分子,但该物质属于非电解质,符合该条件的物质是( )
| A. | Cl2 | B. | CO2 | C. | NO2 | D. | NaCl |
7.下列物质加入水中,因水解而使溶液呈酸性的是( )
| A. | CuCl2 | B. | NaHSO4 | C. | NaHCO3 | D. | SO2 |
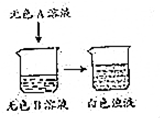 在某校举行的科技节活动中,一位同学在老师的指导下表演了化学小魔术-“清水变牛奶”,道具如图所示,当将无色A溶液加入烧杯中时,无色溶液变成白色浊液.请你利用所学化学知识揭开其中之谜.
在某校举行的科技节活动中,一位同学在老师的指导下表演了化学小魔术-“清水变牛奶”,道具如图所示,当将无色A溶液加入烧杯中时,无色溶液变成白色浊液.请你利用所学化学知识揭开其中之谜.