题目内容
18.现有四种溶液:①0.01mol/L HCl溶液 ②PH=2的CH3COOH溶液 ③PH=12的NaOH溶液 ④0.01mol/LNH3•H2O溶液,下列有关四种溶液的说法中不正确的是( )| A. | 水的电离程度:①=②=③<④ | B. | 与相同Zn粒反应平均速率:①<② | ||
| C. | 溶液PH值:①=②<③<④ | D. | 稀释相同的倍数所得溶液PH值:③>④ |
分析 弱电解质在水溶液里存在电离平衡,强电解质在水溶液里完全电离,①0.01mol/L HCl溶液中氢离子浓度为0.01mol/L ②PH=2的CH3COOH溶液中氢离子浓度为0.01mol/L ③PH=12的NaOH溶液中氢氧根离子浓度为0.01mol/L ④0.01mol/LNH3•H2O溶液中氢氧根离子浓度小于0.01mol/L,
A.酸或碱抑制水电离,氢离子或氢氧根离子浓度越大,对水电离的抑制程度越大;
B.氢离子浓度越大,与锌反应的速率越大;
C.碱的pH大于7,酸的pH小于7,弱电解质部分电离;
D.加水稀释促进弱电解质的电离.
解答 解:弱电解质在水溶液里存在电离平衡,强电解质在水溶液里完全电离,所以物质的量浓度相等的盐酸和醋酸,醋酸的pH大于盐酸,pH相等的氨水和氢氧化钠溶液,氨水浓度大于氢氧化钠溶液,
A.酸或碱抑制水电离,氢离子或氢氧根离子浓度越大,对水电离的抑制程度越大,④中水的电离程度最大,①②③中水的电离程度相等,故A正确;
B.氢离子浓度越大,与锌反应的速率越大,①0.01mol/L HCl溶液 ②PH=2的CH3COOH溶液,二者开始时氢离子浓度相同,随着反应进行,HCl氢离子浓度减小,醋酸C.①0.01mol/L HCl溶液的pH=2 ②PH=2的CH3COOH溶液 ③PH=12的NaOH溶液 ④0.01mol/LNH3•H2O溶液中LNH3•H2O部分电离,氢氧根离子浓度小于0.01mol/L,则pH<12,所以溶液PH值:①=②<④<③,故C错误;
D.③④稀释相同的倍数,稀释过程中促进一水合氨电离,导致氨水中氢氧根离子浓度大于氢氧化钠溶液,则pH③>④,故D正确;
故选C.
点评 本题考查了弱电解质的电离、酸碱混合溶液定性判断等知识点,明确弱电解质电离特点是解本题关键,知道哪些物质促进水电离哪些物质抑制水电离,题目难度中等.

 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案| A. | Na2O2与CO2反应当产生0.1molO2时转移电子数为0.4NA | |
| B. | 10gNH4+中含有的电子数为NA | |
| C. | 11.2LO2和N2的混合气体含有的分子数为0.5NA | |
| D. | 25℃、101Pa时,16g O2和O3混合气体中含有的原子数为NA |
| A. | 加入NaHCO3晶体 | B. | 加入NaNO3晶体 | ||
| C. | 加入NaHSO4晶体 | D. | 加入NH4Al(SO4)2晶体 |
| A. | 取2 L 1 mol/L AlCl3溶液,其所含Al3+的数目为2NA | |
| B. | 中和等体积、等物质的量浓度的盐酸和醋酸,盐酸所消耗氢氧化钠更少 | |
| C. | 在一定的温度和催化剂条件下,1.6g O2和足量SO2反应转移电子数为0.2NA | |
| D. | 溶质的物质的量相同的Na3PO4溶液和H3PO4溶液中PO43-的数目前者大于后者 |
| A. | NaHSO3在溶液中的电离:NaHSO3=Na++H++SO32- | |
| B. | Cl-的结构示意图: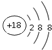 | |
| C. | HClO结构式:H-Cl-O | |
| D. | 医用钡餐的化学式:BaSO4 |
| A. | CuO分别与稀硫酸、稀盐酸反应 | |
| B. | CaCO3、Na2CO3分别与盐酸反应 | |
| C. | H2SO4、K2SO4溶液分别与Ba(OH)2溶液反应 | |
| D. | Na、Mg分别与稀盐酸反应 |
| A. | Cl2 | B. | CO2 | C. | NO2 | D. | NaCl |