题目内容
【题目】常温下,将11.65gBaSO4粉末置于盛有250mL蒸馏水的烧杯中,然后向烧杯中加入Na2CO3固体(忽视溶液体积的变化)并充分搅拌,加入Na2CO3固体的过程中,溶液中几种离子的浓度变化曲线如图所示,下列说法中正确的是
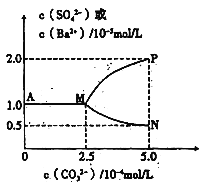
A. 相同温度时,Ksp(BaSO4)>Ksp(BaCO3)
B. BaSO4在水中的溶解度、Ksp均比在BaCl2溶液中的大
C. 若使0.05molBaSO4全部转化为BaCO3,至少要加入1.25molNa2CO3
D. 0.05molBaSO4恰好全部转化为BaCO3时,溶液中离子浓度大小为:c(CO32-)>c(SO42-)>c(Ba2+)
【答案】D
【解析】:![]() 比
比![]() 更难溶,二者是同类型物质,可以直接根据溶解性情况比较
更难溶,二者是同类型物质,可以直接根据溶解性情况比较![]() 大小,因此相同温度时,
大小,因此相同温度时,![]() ,故A错误;
,故A错误;![]() 在
在![]() 溶液中因为
溶液中因为![]() 的存在,使沉淀溶解平衡向逆向方向移动,因此在
的存在,使沉淀溶解平衡向逆向方向移动,因此在![]() 溶液中的溶解度不大,
溶液中的溶解度不大,![]() 只随温度的改变而改变,无论在水中还是
只随温度的改变而改变,无论在水中还是![]() 溶液中,
溶液中,![]() 值是不变的,故B错误;
值是不变的,故B错误;![]()
![]() 粉末,其物质的量为
粉末,其物质的量为![]() ,使
,使![]() 转化为
转化为![]() ,发生的反应为
,发生的反应为![]()
![]() ,根据图象
,根据图象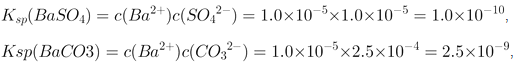 反应的平衡常数为
反应的平衡常数为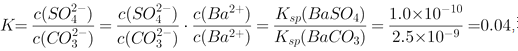 ,若使
,若使![]() 全部转化为
全部转化为![]() ,则反应生成
,则反应生成![]() ,反应的离子积为
,反应的离子积为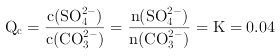 ,则平衡时
,则平衡时![]() ,则至少需要
,则至少需要![]() ,故C错误;
,故C错误;![]() 恰好全部转化为
恰好全部转化为![]() 时,溶液中存在大量的
时,溶液中存在大量的![]() ,平衡时
,平衡时![]() 的浓度大于
的浓度大于![]() ,
,![]() 水解促进
水解促进![]() 的形成,因此溶液中浓度最小的是
的形成,因此溶液中浓度最小的是![]() ,因此离子浓度大小关系为:
,因此离子浓度大小关系为:![]() ,所以D选项是正确的.所以D选项是正确的。
,所以D选项是正确的.所以D选项是正确的。

练习册系列答案
相关题目