题目内容
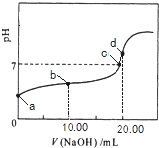
【题目】25℃时,向某Na2CO3溶液中加入稀盐酸,溶液中含碳微粒的物质的量分数(φ)随溶液pH变化的部分情况如图所示。下列说法中正确的是
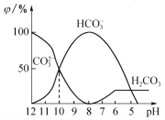
A. Na2CO3溶液中c(Na+)=c(CO32-)+ c(HCO3-)+ c(H2CO3)
B. pH=8时,溶液中c(Cl-)=c(Na+)
C. pH =7时,溶液中的c(Na+)>c(Cl-)>c(HCO3-)>c(H+)=c(OH-)
D. 25℃时,CO32-+H2O![]() HCO3-+OH-的Kh=10-10mol·L-1
HCO3-+OH-的Kh=10-10mol·L-1
【答案】C
【解析】A.根据物料守恒可知,Na2CO3溶液中c(Na+)=2c(CO32-)+ 2c(HCO3-)+ 2c(H2CO3),A错误; B. pH=8时,由图像可知Na2CO3与盐酸完全反应生成碳酸氢钠和氯化钠,溶液中: c(Cl-)<c(Na+),B错误;C. pH =7时,溶液中存在电荷守恒:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)+ c(Cl-),且c(H+)=c(OH-),所以离子浓度大小关系为:c(Na+)>c(Cl-)>c(HCO3-)>c(H+)=c(OH-),C正确;D. pH=10时,c(CO32-)=c(HCO3-),CO32-+H2O![]() HCO3-+OH-的Kh=
HCO3-+OH-的Kh=![]() = c(OH-)=
= c(OH-)=![]() mol·L-1,D错误;答案选C.
mol·L-1,D错误;答案选C.

 阅读快车系列答案
阅读快车系列答案【题目】某化学兴趣小组的同学探究KI的化学性质。
(1)KI组成中含有钾元素,可知它能发生__________反应。
(2)①根据碘元素的化合价可推知KI有__________性。
②与KI反应,能体现上述性质的试剂有_________(填序号)
a、Fe2+ b、Fe3+ c、Br- d、Cl2
(3)兴趣小组的同学们猜测:Cu2+有可能氧化I-,为了验证,他们做了如下实验。(已知:CuI为不溶于水的白色沉淀)
操作 | 现象 |
| 溶液分层,上层显紫色,有白色沉淀生成 |
结论:Cu2+_________(填能或不能)氧化I-。若能氧化,写出反应的离子方程式_____________________ (若认为不能氧化,此空不用填写)。
(4)①同学们依据(3)的结论推测:Ag+能氧化I-,原因为___________。
他们做了如下实验进行探究
实验一:
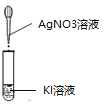
操作 | 现象 |
| 生成黄色沉淀 |
②发生反应的化学方程式为_________________________________。
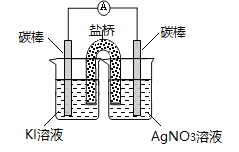
实验二:
操作 | 现象 |
| 3分钟后KI溶液开始变黄,随后溶液黄色加深,取出该烧杯中溶液滴入盛有淀粉溶液的试管,溶液变蓝。 |
③甲同学认为根据上述实验现象不能说明Ag+能氧化I-,原因是_______________________________。
乙同学在上述实验基础上进行了改进,并得出结论:Ag+能氧化I-。发生反应的离子方程式为____________________________________。
由以上两个实验得出的结论为________________________________。